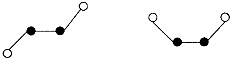题目内容
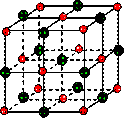
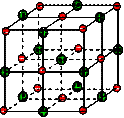
在离子晶体中,阴阳离子按一定规律在空间排列,如图(1)所示即是NaCl的晶体结构,这两种离子在空间三个互相垂直的方向上都是等距离排列的。
①在晶体中,每个Na+离子周围与它最接近的、且距离相等的Cl-共有 个。
每个Na+离子周围与它最接近的、且距离相等的Na+共有 个。而Na+离子数目与Cl-离子数目之比为 。
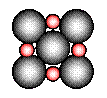
②在离子晶体中,阴阳离子具有球对称的电子云。它们可以被看成是不等径的刚性圆球,并彼此相切(如图⑵所示)。离子键的键长是相邻阴阳离子的半径之和(如图⑶所示),已知a为常数。
![]()
|
a
(1) (2) (3)
③试回答下列问题:
NaCl晶体中离子键的键长为 。Na+离子半径与Cl-离子
半径比r+/r- = 。(已知 √2=1.414 , √3=1.732, √5=2.236)
④NaCl晶体中不存在分子,但在温度达到1413℃时,NaCl晶体形成气体,并以分子形式存在,现有29.25gNaCl晶体,强热使温度达到1450℃,测得气体体积为5.6L(已折算为标准状况),则此时氯化钠气体的分子式为 。
⑤纳米材料的表面原子占总原子数的比例极大,这是它具有许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和形状恰好等于氯化钠晶胞的大小和形状,则这种纳米颗粒的表面原子占总原子数的百分数为 。
① 6、12、1:1; ③ a/2、√2-1 ④ Na2Cl2 ⑤ 96.3%
解析:
由题意29.25g氯化钠在1450℃时为0.25mol,故其摩尔质量为117g·mol-1,所以氯化钠气体的分子式为Na2Cl2。

(16分)在离子晶体中,阴阳离子按一定规律在空间排列,如图(1)所示即是NaCl的晶体结构,这两种离子在空间三个互相垂直的方向上都是等距离排列的。 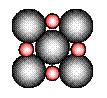
①在晶体中,每个Na+离子周围与它最接近的、且距离相等的Cl-共有 个。
每个Na+离子周围与它最接近的、且距离相等的Na+共有 个。而Na+离子数目与Cl-离子数目之比为 。
②在离子晶体中,阴阳离子具有球对称的电子云。它们可以被看成是不等径的刚性圆球,并彼此相切(如图⑵所示)。离子键的键长是相邻阴阳离子的半径之和(如图⑶所示),已知a为常数。
|
(1) (2) (3)
③试回答下列问题:
NaCl晶体中离子键的键长为 。Na+离子半径与Cl-离子
半径比r+/r- = 。(已知√2="1.414" , √3="1.732, " √5=2.236)
④NaCl晶体中不存在分子,但在温度达到1413℃时,NaCl晶体形成气体,并以分子形式存在,现有29.25gNaCl晶体,强热使温度达到1450℃,测得气体体积为5.6L(已折算为标准状况),则此时氯化钠气体的分子式为 。
⑤纳米材料的表面原子占总原子数的比例极大,这是它具有许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和形状恰好等于氯化钠晶胞的大小和形状,则这种纳米颗粒的表面原子占总原子数的百分数为 。

 (2010?大连二模)[选修-物质结构与性质]
(2010?大连二模)[选修-物质结构与性质]