题目内容
【题目】碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以纯铜屑为原料制取的流程如下:
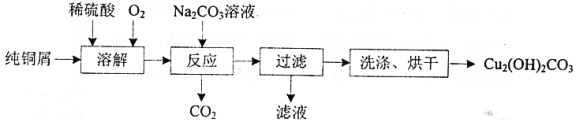
(1)“溶解”步骤反应的离子方程式为_______.温度宜控制在50℃左右,若高于50℃,溶液中O2溶解量减少、Cu的转化率降低,若低于50℃ ,_____
(2)“反应”步骤生成Cu2(OH)2CO3的化学方程式为_________。反应后溶液中铜元素残留量受pH和反应时间的影响如图所示:
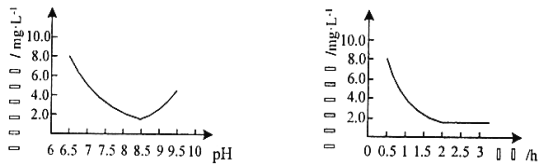
判断反应的最佳条件: pH为___、反应时间为____h。
(3)检验Cu2(OH)2CO3洗涤是否完全的方法是____________________
(4) Cu2(OH)2CO3也可以表示为CuCO3·Cu(OH)2。 查阅文献,上述反应条件下还可能生成少量CuCO3·Cu(OH)2。为测定产品的纯度[产品中Cu2(OH)2CO3的质量分数],取10.97g干燥样品,400℃左右加热,测得固体质量随时间变化关系如图所示。
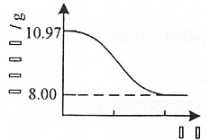
已知: 8.00g固体为黑色纯净物。
有关物质的摩尔质量如表:
物质 | CuCO3·Cu(OH)2 | CuCO3·2Cu(OH)2 | CuO |
摩尔质量/g·mol-1 | 222 | 320 | 80 |
请计算产品的纯度(写出计算过程,结果保留3位有效数字)。______
【答案】2Cu+O2+4H+![]() 2Cu2+ +2H2O 反应(或溶解)速率慢 2CuSO4+2Na2CO3+H2O = Cu2(OH)2CO3↓+2Na2SO4+CO2↑ 8.5 2 取最后一次洗涤的滤液少许于试管中,滴加盐酸酸化的BaCl2溶液[或先加稀盐酸再加BaCl2或Ba(NO3)2溶液],若出现浑浊,则说明Cu2(OH)2CO3未洗涤干净,反之则反 设CuCO3·Cu(OH)2的物质的量为x,杂质CuCO3·2Cu(OH)2的物质的量为y,
2Cu2+ +2H2O 反应(或溶解)速率慢 2CuSO4+2Na2CO3+H2O = Cu2(OH)2CO3↓+2Na2SO4+CO2↑ 8.5 2 取最后一次洗涤的滤液少许于试管中,滴加盐酸酸化的BaCl2溶液[或先加稀盐酸再加BaCl2或Ba(NO3)2溶液],若出现浑浊,则说明Cu2(OH)2CO3未洗涤干净,反之则反 设CuCO3·Cu(OH)2的物质的量为x,杂质CuCO3·2Cu(OH)2的物质的量为y,
依据原样品的质量10.97g,下列等式222 g·mol-1x+320 g·mol-1 y=10.97g①由图像分析出样品最终分解得到CuO8g,![]() ,根据铜元素守恒2x+3y=0.1mol②,联合解等式①②可得:x=0.035mol,y=0.01mol;故
,根据铜元素守恒2x+3y=0.1mol②,联合解等式①②可得:x=0.035mol,y=0.01mol;故![]() ,
,![]()
【解析】
纯铜屑中加入稀硫酸再通入氧气,反应生成了硫酸铜和水,在上述溶液中加入Na2CO3后,通过调节pH值可以让铜离子析出沉淀碱式碳酸铜,同时放出CO2气体,最后经过洗涤,干燥即可得到纯净的碱式碳酸铜,据此进行解题。
(1)据分析可知:“溶解”步骤发生的反应为2Cu+O2+2H2SO4![]() 2CuSO4+2H2O,故其离子方程式为2Cu+O2+4H+
2CuSO4+2H2O,故其离子方程式为2Cu+O2+4H+![]() 2Cu2++2H2O,温度宜控制在50℃左右,若高于50℃,溶液中O2溶解量减少、Cu的转化率降低,若低于50℃,温度太低,当然是反应速率减慢,影响实验的效率,故答案为:2Cu+O2+4H+
2Cu2++2H2O,温度宜控制在50℃左右,若高于50℃,溶液中O2溶解量减少、Cu的转化率降低,若低于50℃,温度太低,当然是反应速率减慢,影响实验的效率,故答案为:2Cu+O2+4H+![]() 2Cu2++2H2O;反应(或溶解)速率慢;
2Cu2++2H2O;反应(或溶解)速率慢;
(2)根据流程图中可知:“反应”步骤是由CuSO4溶液和Na2CO3反应生成Cu2(OH)2CO3同时放出CO2,故化学方程式为2CuSO4+2Na2CO3+H2O = Cu2(OH)2CO3↓+2Na2SO4+CO2↑,据左图可知pH等于8.5时铜的残留量最小,说明铜离子沉淀得最完全,据右图可知,当时间进行到2小时左右时,铜得残留量达到最低,再往后虽然略有下降,但很不明显,且浪费时间,故答案为:2CuSO4+2Na2CO3+H2O = Cu2(OH)2CO3↓+2Na2SO4+CO2↑;8.5;2;
(3)检验Cu2(OH)2CO3洗涤主要除去表面得杂质Na2SO4等,但是碱式硫酸铜也会极少数溶解,故要想检验是否完全洗涤干净,需检验最后一次洗涤液中是否有![]() ,由于有
,由于有![]() 的影响,故最后得检验方法为取最后一次洗涤的滤液少许于试管中,滴加盐酸酸化的BaCl2溶液[或先加稀盐酸再加BaCl2或Ba(NO3)2溶液],若出现浑浊,则说明Cu2(OH)2CO3未洗涤干净,反之则反;
的影响,故最后得检验方法为取最后一次洗涤的滤液少许于试管中,滴加盐酸酸化的BaCl2溶液[或先加稀盐酸再加BaCl2或Ba(NO3)2溶液],若出现浑浊,则说明Cu2(OH)2CO3未洗涤干净,反之则反;
(4) 设CuCO3·Cu(OH)2的物质的量为x,杂质CuCO3·2Cu(OH)2的物质的量为y,
依据原样品的质量10.97g,下列等式222 g·mol-1x+320 g·mol-1y=10.97g①由图像分析出样品最终分解得到CuO8g,![]()
![]() ,
,![]() ,故答案为:设CuCO3·Cu(OH)2的物质的量为x,杂质CuCO3·2Cu(OH)2的物质的量为y,
,故答案为:设CuCO3·Cu(OH)2的物质的量为x,杂质CuCO3·2Cu(OH)2的物质的量为y,
依据原样品的质量10.97g,下列等式222 g·mol-1x+320 g·mol-1y=10.97g①由图像分析出样品最终分解得到CuO8g,![]() ,根据铜元素守恒2x+3y=0.1mol②,联合解等式①②可得:x=0.035mol,y=0.01mol;故
,根据铜元素守恒2x+3y=0.1mol②,联合解等式①②可得:x=0.035mol,y=0.01mol;故![]() ,
,![]()

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案【题目】某温度下,在体积可变的容器中发生反应:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(l),改变起始时加入各物质的量,在不同压强下达平衡时CH3OCH3(g)的物质的量如表所示,下列说法错误的是( )
CH3OCH3(g)+3H2O(l),改变起始时加入各物质的量,在不同压强下达平衡时CH3OCH3(g)的物质的量如表所示,下列说法错误的是( )
压强 | P1 | P2 | P3 | |
n/mol | ①2.0molCO2 6.0molH2 | 0.10mol | 0.04mol | 0.02mol |
②1.0molCO2 3.0molH2 | x 1 | y 1 | z 1 | |
③1.0molCH3OCH3 3.0molH2O | x 2 | y 2 | z 2 | |
A.P1>P2B.x 1=0.05
C.P2条件下,③中CH3OCH3平衡转化率为96%D.若该反应可自发进行,则高温更有利