题目内容
【题目】短周期主族元素A、B、C、D、E、F的原子序数依次递增,A是自然界中形成化合物种类最多的元素,且A、B两元素在元素周期表中相邻,B、C、E原子的最外层电子数之和为13,C原子最外层电子数是E原子最外层电子数的3倍,B、F原子最外层电子数之和等于C、E原子最外层电子数之和,D在同周期元素中原子半径最大。
请回答下列问题:
(1)A的元素符号为_______,其在元素周期表的位置:第______周期,第______族。
(2)元素A、B形成的最简单的气态氢化物稳定性较强的是_______ (填化学式),元素C和D可形成化合物D2C2,其电子式为_______ 。
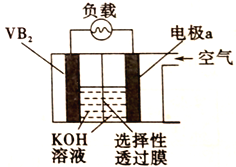
(3)F的单质加入到D的最高价氧化物对应水化物的溶液中,发生反应的离子方程式为________;上述反应的气体产物和C元素的单质设计成的燃料电池已用于航天飞机。试写出以30%KOH溶液为电解质溶液的这种电池在工作时负极的电极反应式为________ 。
(4)工业制取E的化学反应方程式为_______。
【答案】 C 二 ⅣA NH3 ![]() 2Al+2OH- +2H2O=2AlO2- +3H2 ↑ H2-2e-+2OH- =2H2O MgCl2(熔融)
2Al+2OH- +2H2O=2AlO2- +3H2 ↑ H2-2e-+2OH- =2H2O MgCl2(熔融) ![]() Mg + Cl2↑
Mg + Cl2↑
【解析】短周期主族元素A、B、C、D、E、F的原子序数依次递增,A是自然界中形成化合物种类最多的元素,A、B两元素相邻,所以A为碳元素,B为氮元素;因为B、C、E原子的最外层电子数之和为13,B的最外层电子数为5,则C、E原子的最外层电子数之和为8,C原子最外层电子数是E原子最外层电子数的3倍,则C的最外层电子数为6,E的最外层电子数为2,因此C为氧元素,E为镁元素;B、F原子最外层电子数之和等于C、E原子最外层电子数之和,则F的最外层电子数为3,F为铝元素,D在同周期元素中原子半径最大,则D为钠元素,据此答题。
(1)A为碳元素,在元素周期表的第二周期ⅣA族,故答案为:C;二;ⅣA;
(2)元素A、B形成的最简单的气态氢化物稳定性强弱关系为NH3>CH4,元素C和D可形成D2C2,为过氧化钠,电子式为![]() ,故答案为:NH3;
,故答案为:NH3;![]() ;
;
(3)铝和氢氧化钠溶液发生反应的离子方程式为2Al+2OH- +2H2O=2AlO2- +3H2 ↑,氢气与氧气构成的燃料电池,在30%KOH溶液为电解质溶液的这种电池的负极反应式为:H2-2e-+2OH-=2H2O,故答案为:2Al+2OH- +2H2O=2AlO2- +3H2 ↑;H2-2e-+2OH-=2H2O;
(4)工业上通过电解熔融氯化镁的方法冶炼金属镁,化学反应方程式为MgCl2(熔融) ![]() Mg + Cl2↑,故答案为:MgCl2(熔融)
Mg + Cl2↑,故答案为:MgCl2(熔融) ![]() Mg + Cl2↑。
Mg + Cl2↑。

 阅读快车系列答案
阅读快车系列答案