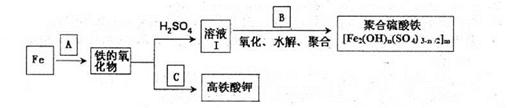
题目内容
将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:(要写计算过程)
(1)NO的体积为 _L,NO2的体积为 _L;(保留2位有效数字)
(2)待产生的气体全部释放后,向溶液中加入V mL a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+ 全部转化成沉淀,则原硝酸溶液的浓度为 mol·L-1。(列出计算式即可)
(1)NO的体积为 _L,NO2的体积为 _L;(保留2位有效数字)
(2)待产生的气体全部释放后,向溶液中加入V mL a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+ 全部转化成沉淀,则原硝酸溶液的浓度为 mol·L-1。(列出计算式即可)
(8分)(1)5.8 L 5.4 L (2)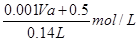 (各2分,过程2分)
(各2分,过程2分)
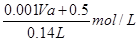 (各2分,过程2分)
(各2分,过程2分)试题分析:(1)设混合气中NO和NO2的物质的量分别是x和y
则x+y=11.2L÷22.4L/mol=0.5mol
金属铜的物质的量是32.64g÷64g/mol=0.51mol
则根据电子的得失守恒可知3x+y=0.51mol×2
解得x=0.26mol、y=0.24mol
所以NO和NO2的体积分别是0.26mol×22.4L/mol=5.8L
0.24mol×22.4L/mol=5.4L
(2)溶液中的Cu2+ 全部转化成沉淀后,溶液中的溶质恰好是硝酸钠
则根据原子守恒可知,硝酸钠的物质的量是0.001Vamol
所以原硝酸溶液的浓度为
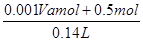 =
=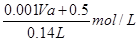
点评:该题是中等难度的试题,试题基础性强,侧重对学生能力的培养与基础知识的巩固与训练,难度不大。有助于培养学生的逻辑推理能力和规范的答题能力,也有利于提高学生的应试能力和学习效率。该题的关键是利用好几种守恒关系,即原子守恒、电子的得失守恒以及质量守恒定律等

练习册系列答案
相关题目
 2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 。
2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 。