题目内容
【题目】元素X、Y、Z为前四周期元素,X的基态原子核外电子有21种运动状态,元素Y的原子最外层电子数是其内层的3倍,Z与X、Y不在同一周期,且Z原子核外p电子比s电子多5个。
(1)X基态原子的核外电子排布式为______。
(2)X是石油化工中重要的催化剂之一,如催化异丙苯(![]() )裂化生成苯和丙烯。
)裂化生成苯和丙烯。
①1 mol异丙苯分子中含有σ键的数目为________mol。
②异丙苯分子中碳原子轨道的杂化类型为________。
(3)与Y3分子互为等电子体的阴离子为________。
(4)XZ3易溶于水,熔融状态下能够导电,据此可判断XZ3晶体属于________(填晶体类型)。
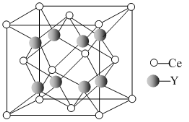
(5)元素Ce与Y形成的化合物晶体的晶胞结构如下图,该化合物的化学式为________。
【答案】[Ar]3d14s2 20 sp2、sp3 NO2- 离子晶体 CeO2
【解析】
元素X、Y、Z为前四周期元素,X的基态原子核外电子有21种运动状态,则X核外电子数为21,为21号Sc元素。元素Y的原子最外层电子数是其内层的3倍,由于最外层电子数不能超过8,所以Y原子只能有2个电子层,最外层电子数为6,则Y为O元素。Z与X、Y不在同一周期,且Z原子核外p电子比s电子多5个,Z只能处于第三周期,核外电子排布式为1s22s22p63s23p5,故Z为Cl元素。
根据上述推断可知X是Sc元素,Y是O元素,Z是Cl元素。
(1)X是21号Sc元素,根据构造原理,可知Sc基态原子的核外电子排布式为1s22s22p63s23p63d14s2,也可写为[Ar]3d14s2;
(2)①根据异丙苯的结构简式![]() 可知:在一个异丙苯分子中含有20个σ键,则在1 mol异丙苯分子中含有σ键的数目为20mol;
可知:在一个异丙苯分子中含有20个σ键,则在1 mol异丙苯分子中含有σ键的数目为20mol;
②异丙苯分子中苯环上的碳原子杂化方式为sp2杂化,饱和C原子为sp3杂化;
(3)根据等电子体的概念可知:与O3分子互为等电子体的阴离子为NO2-;
(4)XZ3是ScCl3,该物质易溶于水,熔融状态下能够导电,说明在晶体中含有离子,据此可判断XZ3晶体属于离子晶体;
(5)在1个晶胞中含有Se原子个数为:![]() =4;含有O原子数目为8,则Ce、O原子数目之比为4:8=1:2,所以Ce、O形成的化合物化学式为CeO2。
=4;含有O原子数目为8,则Ce、O原子数目之比为4:8=1:2,所以Ce、O形成的化合物化学式为CeO2。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案