��Ŀ����
A���л������Σ�B��C��D�dz�������� A��B��C��D��ɫ��Ӧ�ʻ�ɫ��ˮ��Һ���ʼ��ԣ�����B�ļ�����ǿ��X��Y��������������������塢����ϢϢ��أ����ǵľ���������ͬ��A��B�����ʵ�����Ӧ����D��һ�����嵥�ʣ�C���ȷֽ�õ�Y��D��X��B��C��Ӧ����D��X��E������Ԫ����ɣ�ʽ��Ϊ83����EͶ��X�еõ�B������Z��Z�ڱ�״���µ��ܶ�Ϊ0.76g��L-1��
��1��A�Ļ�ѧʽ�� ��Y�ĵ���ʽ�� ��
��2��X�ķе��ͬ����ͬ��������Ҫ�ߣ�ԭ���� ��
��3��д��E���������ᷴӦ�Ļ�ѧ����ʽ
��4��д����D�ı�����Һ�в���ͨY����C�����ӷ���ʽ ��
��5��A��һ����ҪӦ���Ǹ���2A ��P +H2���õ�P��P��Һ�е�������ͨ����CaCl2ʹ֮������������ȫ����ʱ����Һ��Ca2+�����ʵ���Ũ������Ϊ ��
������Ksp=2.3��10-9������Һ������Ũ�ȡ�10-5mol��L-1��������Ϊ��ȫ������
��6��ʵ���ҳ���P������HCl��Ӧ���õ��л�����Ũ���������¹��ȷֽ���ij��ԭ�����壬���ʵ��֤���ֽ�����л�ԭ������Ĵ��� ��
��1��A�Ļ�ѧʽ�� ��Y�ĵ���ʽ�� ��
��2��X�ķе��ͬ����ͬ��������Ҫ�ߣ�ԭ���� ��
��3��д��E���������ᷴӦ�Ļ�ѧ����ʽ
��4��д����D�ı�����Һ�в���ͨY����C�����ӷ���ʽ ��
��5��A��һ����ҪӦ���Ǹ���2A ��P +H2���õ�P��P��Һ�е�������ͨ����CaCl2ʹ֮������������ȫ����ʱ����Һ��Ca2+�����ʵ���Ũ������Ϊ ��
������Ksp=2.3��10-9������Һ������Ũ�ȡ�10-5mol��L-1��������Ϊ��ȫ������
��6��ʵ���ҳ���P������HCl��Ӧ���õ��л�����Ũ���������¹��ȷֽ���ij��ԭ�����壬���ʵ��֤���ֽ�����л�ԭ������Ĵ��� ��
��1��HCOONa��2�֣� 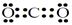 ��2�֣�
��2�֣�
��2��ˮ���Ӽ���������2�֣�
��3��Na3N+4HCl=3NaCl+NH4Cl��2�֣�
��4��2Na++CO32-+H2O+CO2==2NaHCO3����2�֣�
��5��2.3��10-4mol��L-1��2�֣�
��6��������������ͨ������NaOH��Һ����ͨ������ʯ��ˮ��������ȼʣ�����壬�������ó���ʯ��ˮ��ʪ�����ձ������ڻ����Ϸ����ձ��ڱڱ���ǣ�˵���л�ԭ������CO�Ĵ��ڡ���3�֣�������������Ҳ���֣�
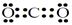 ��2�֣�
��2�֣� ��2��ˮ���Ӽ���������2�֣�
��3��Na3N+4HCl=3NaCl+NH4Cl��2�֣�
��4��2Na++CO32-+H2O+CO2==2NaHCO3����2�֣�
��5��2.3��10-4mol��L-1��2�֣�
��6��������������ͨ������NaOH��Һ����ͨ������ʯ��ˮ��������ȼʣ�����壬�������ó���ʯ��ˮ��ʪ�����ձ������ڻ����Ϸ����ձ��ڱڱ���ǣ�˵���л�ԭ������CO�Ĵ��ڡ���3�֣�������������Ҳ���֣�
����������� ��֪A���л������Σ�B��C��D�dz�������� A��B��C��D��ɫ��Ӧ�ʻ�ɫ��ˮ��Һ���ʼ��ԡ������֪������A��B��C��D��Ϊ����NaԪ�صļ��ǿ�������Σ�B�ļ�����ǿ����BΪNaOH���� X��Y��������������������塢����ϢϢ��أ����ǵľ���������ͬ����X��YӦΪH2O��CO2���� ��C���ȷֽ�õ�Y��D��X��B��C��Ӧ����D��X������֪CΪNaHCO3��DΪNa2CO3����2 NaHCO3
 Na2CO3 +CO2��+H2O�� NaHCO3 +NaOH =Na2CO3 +H2O�� �ɴ˿�ȷ��XΪH2O��YΪCO2���� ���л�������A��NaOH�����ʵ�����Ӧ����Na2CO3��һ�����嵥�ʣ������뵽����ˮ��������NaOH���ȷ�Ӧ��ȡ��������ȷ�Ӧ��
Na2CO3 +CO2��+H2O�� NaHCO3 +NaOH =Na2CO3 +H2O�� �ɴ˿�ȷ��XΪH2O��YΪCO2���� ���л�������A��NaOH�����ʵ�����Ӧ����Na2CO3��һ�����嵥�ʣ������뵽����ˮ��������NaOH���ȷ�Ӧ��ȡ��������ȷ�Ӧ��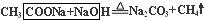 ���ɴ�Ǩ�ƿ�֪��AΪ�����ƣ�HCOONa����������ʵ���NaOH�������ȷ�Ӧ����Na2CO3��������
���ɴ�Ǩ�ƿ�֪��AΪ�����ƣ�HCOONa����������ʵ���NaOH�������ȷ�Ӧ����Na2CO3��������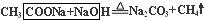 ���� E������Ԫ����ɣ�ʽ��Ϊ83����EͶ��H2O�еõ�NaOH������Z��Z�ڱ�״���µ��ܶ�Ϊ0.76g��L-1���ɼ����֪����Z����Է���������17����ZΪNH3���ɸ÷�Ӧ��E + H2O �� NaOH + NH3��������֪E��Na��N����Ԫ����ɣ��ٸ���Ԫ�ػ��ϼۿ�ȷ��E��Na3N��
���� E������Ԫ����ɣ�ʽ��Ϊ83����EͶ��H2O�еõ�NaOH������Z��Z�ڱ�״���µ��ܶ�Ϊ0.76g��L-1���ɼ����֪����Z����Է���������17����ZΪNH3���ɸ÷�Ӧ��E + H2O �� NaOH + NH3��������֪E��Na��N����Ԫ����ɣ��ٸ���Ԫ�ػ��ϼۿ�ȷ��E��Na3N���ɴ˿ɽ��
��1��A�Ļ�ѧʽ�� HCOONa ��Y�ĵ���ʽ��
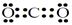
��2��X�ķе��ͬ����ͬ��������Ҫ�ߵ�ԭ���ǣ�ˮ���Ӽ����������Ӷ�ʹ���Ӽ����������ӣ�����нϸߵķе㡣
��3��E���������ᷴӦ�Ļ�ѧ����ʽ��Na3N + 4HCl =" 3NaOH" + NH4Cl ��
��4��D�ı�����Һ�в���ͨ��ͨY����C�����ӷ���ʽΪ��
2Na++CO32-+H2O+CO2 = 2NaHCO3��
��5������2A ��P +H2���õ�P����֪��2HCOONa ��Na2C2O4 + H2����PΪNa2C2O4��C2O42- + Ca2+ = CaC2O4��������Ksp(CaC2O4) = c(Ca2+)?c(C2O42-) = 2.3��10-9���ɼ������CaC2O4��ȫ����ʱ����Һ��Ca2+�����ʵ���Ũ������Ϊ��c(Ca2+) =
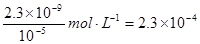 mol?L-1
mol?L-1��6��ʵ����Na2C2O4������HCl��Ӧ�ɵõ�H2C2O4 ��H2C2O4��Ũ���������¹��ȷֽ�����CO��CO2��H2O ( �� H2C2O4
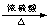 CO�� + CO2��+ H2O )�����֤���ֽ�����д��ڻ�ԭ������CO��ʵ��Ϊ��������������ͨ������NaOH��Һ����ͨ��ʢ�й���NaOH�ĸ���ܣ�����ͨ������ʯ��ˮ����������ȼʣ�����壬�������ó���ʯ��ˮ��ʪ�����ձ������ڻ����Ϸ����ձ��ڱڱ���ǣ�˵���л�ԭ������CO�Ĵ��ڡ�
CO�� + CO2��+ H2O )�����֤���ֽ�����д��ڻ�ԭ������CO��ʵ��Ϊ��������������ͨ������NaOH��Һ����ͨ��ʢ�й���NaOH�ĸ���ܣ�����ͨ������ʯ��ˮ����������ȼʣ�����壬�������ó���ʯ��ˮ��ʪ�����ձ������ڻ����Ϸ����ձ��ڱڱ���ǣ�˵���л�ԭ������CO�Ĵ��ڡ�
��ϰ��ϵ�д�
�����Ŀ
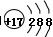 ,���Ԫ�������ڱ���λ�ڵ������ڡ���A��
,���Ԫ�������ڱ���λ�ڵ������ڡ���A��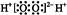
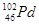 ��
�� ��Ϊͬλ��
��Ϊͬλ��
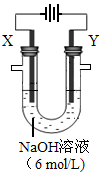
 2H2O��O2���� ������X���ռ�����672 mL����Y���ռ�����168 mL����������Ϊ��������������Y�缫�������� g��
2H2O��O2���� ������X���ռ�����672 mL����Y���ռ�����168 mL����������Ϊ��������������Y�缫�������� g��