题目内容
2013年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。

据此判断:
①该反应的ΔH________0(填“>”或“<”)
②在T2温度下,0~2 s内的平均反应速率v(N2)=______________________。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
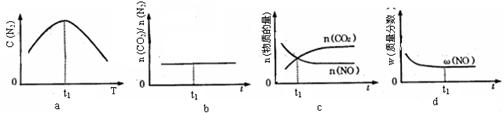
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________(填代号)。


(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH1=-867 kJ/mol
2NO2(g)??N2O4(g) ΔH2=-56.9 kJ/mol
写出CH4(g)催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式:________________________________________________________________________。
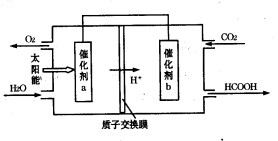
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的
目的。如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为__________________________。

③常温下,0.1 mol·L-1的HCOONa溶液pH为10,则HCOOH的电离常数Ka=________。
(1)①<
②0.025 mol·L-1·s-1或0.025 mol/(L·s)
③如图
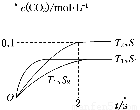
④bd
(2)①CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-810.1 kJ/mol ②CO2+2H++2e-=HCOOH ③10-7mol·L-1
【解析】(1)①由图中曲线可以看出,在催化剂表面积相同的情况下,T1温度时先达到平衡,则T1>T2,但温度高时CO2的浓度小,说明升高温度平衡逆向移动,该反应的正反应为放热反应,即ΔH<0。②v(N2)=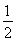 v(CO2)=
v(CO2)=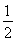 ×
×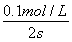 =0.025 mol·L-1·s-1。③温度相同,质量相同的催化剂,表面积越小反应速率越慢。④a项,只能说明t1时正反应速率最快,但不一定处于平衡状态;c项,t1时,只能说明n(NO)=n(CO2),不能说明正逆反应速率相等,不是平衡状态。(2)①根据盖斯定律,将两个热化学方程式相减可得CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-810.1 kJ/mol。②CO2转变成HCOOH,碳的化合价降低,CO2被还原,即CO2发生还原反应与H+结合生成HCOOH。(3)甲酸的电离平衡为HCOOH??H++HCOO-,0.1 mol·L-1的HCOONa溶液中存在水解平衡:H2O+HCOO-??HCOOH+OH-,溶液中c(HCOO-)=(0.1-1.0×10-4) mol·L-1,c(H+)=10-10mol·L-1,c(HCOOH)=10-4mol·L-1,故电离平衡常数Ka=
=0.025 mol·L-1·s-1。③温度相同,质量相同的催化剂,表面积越小反应速率越慢。④a项,只能说明t1时正反应速率最快,但不一定处于平衡状态;c项,t1时,只能说明n(NO)=n(CO2),不能说明正逆反应速率相等,不是平衡状态。(2)①根据盖斯定律,将两个热化学方程式相减可得CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-810.1 kJ/mol。②CO2转变成HCOOH,碳的化合价降低,CO2被还原,即CO2发生还原反应与H+结合生成HCOOH。(3)甲酸的电离平衡为HCOOH??H++HCOO-,0.1 mol·L-1的HCOONa溶液中存在水解平衡:H2O+HCOO-??HCOOH+OH-,溶液中c(HCOO-)=(0.1-1.0×10-4) mol·L-1,c(H+)=10-10mol·L-1,c(HCOOH)=10-4mol·L-1,故电离平衡常数Ka=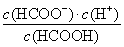 =
=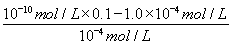 =10-7 mol·L-1。
=10-7 mol·L-1。

 名校课堂系列答案
名校课堂系列答案
 。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如右图所示。
。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如右图所示。 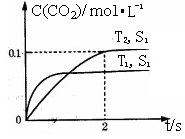
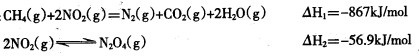
 2CO2(g)+
N2(g)。△H<0
2CO2(g)+
N2(g)。△H<0

 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol  。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如右图所示。
。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如右图所示。 


