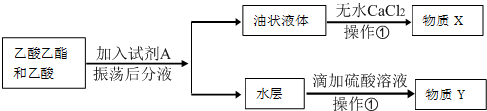
题目内容
5.常温下用石墨作电极,电解100mL 0.1mol•L-1的Cu(NO3)2和0.1mol•L-1的AgNO3组成的混合溶液,当某一电极上生成的气体在标准状况下体积为1.12L时,假设溶液体积不变,下列说法正确的是( )| A. | 阴极增重1.4g | B. | 所得溶液pH<1 | C. | 阴极增重0.64g | D. | 所得溶液pH>1 |
分析 用石墨作电极,电解100ml 0.1mol/L的硝酸铜和0.1mol/L的硝酸银组成的混合溶液,阳极上放电的离子为氢氧根离子,阴极上放电的离子为银离子、铜离子、氢离子,依据电极得失电子守恒讨论产生气体在阴极和阳极分别进行计算.
解答 解:100ml 0.1mol/L的硝酸铜和0.1mol/L的硝酸银组成的混合溶液,含有银离子、铜离子各0.01mol,用石墨作电极电解混合液,当某一电极上生成的气体在标准状况下体积为1.12L时:
1、当阴极上生成的气体体积为1.12L即$\frac{1.12}{22.4}$=0.05mol,说明银离子、铜离子放电完全,溶液中的氢离子放电生成氢气0.05mol,
阴极:Ag++e-=Ag;Cu2++2e-=Cu;2H++2e-=H2↑,
转移电子数:Ag++e-=Ag; Cu2++2e-=Cu; 2H++2e-=H2↑,
0.01 0.01 0.01 0.01 0.02 0.01 0.1 0.1 0.05
共转移电子数0.01+0.02+0.1=0.13(mol),阴极增重0.01×108+0.01×64=1.72g
阳极为氢氧根离子放电生成氧气,电极反应式阳极:4OH--4e-=2H2O+O2↑;
4OH--4e-=2H2O+O2↑
0.13 0.13 $\frac{0.13}{4}$
则反应后溶液中的氢离子浓度为$\frac{(0.13-0.1)mol}{0.1L}$=0.3mol/L,则所得溶液pH<1,故B正确;
2、当阳极上生成的气体体积为1.12L即$\frac{1.12}{22.4}$=0.05mol,电极反应式阳极:4OH--4e-=2H2O+O2↑,则共转移0.05mol×4=0.2mol电子;
阴极:Ag++e-=Ag;Cu2++2e-=Cu;2H++2e-=H2↑;
转移电子数:Ag++e-=Ag; Cu2++2e-=Cu; 2H++2e-=H2↑,
0.01 0.01 0.01 0.01 0.02 0.01 0.17 (0.2-0.03)=0.17 0.085
所以阴极增重0.01×108+0.01×64=1.72g,反应后溶液中的氢离子浓度为$\frac{(0.2-0.17)mol}{0.1L}$=0.3mol/L,则所得溶液pH<1,故B正确;
故选:B.
点评 本题考查了电解池相关计算,明确电解池工作的原理,抓住阴阳两极转移电子守恒是解题关键,题目难度中等.

| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
(2)这些元素的最高价氧化物对应的水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物的电子式
 ;能形成两性氢氧化物的元素是Al.
;能形成两性氢氧化物的元素是Al.(3)①、②、③三种元素的原子半径由大到小的顺序依次为K>Na>Mg.
(4)⑥元素的氢化物是H2O,该氢化物在常温下与②发生反应的化学方程式为2K+2H2O=2KOH+H2↑,所得溶液的pH> 7.
(5)用电子式表示①和⑧元素形成化合物的过程
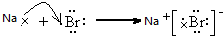 .
. | A. | 赤铁矿:Fe2O3 | B. | 硫铁矿:FeS | ||
| C. | 玛瑙:SiO2 | D. | 芒硝:Na2SO4•10H2O |
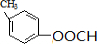
| A. | C2H5Cl→CH2=CH2 | B. |  → → | ||
| C. | CH≡CH→CH2=CH2 | D. | CH3COOH→CH3COOC2H5 |
| A. | 比4He少一个质子 | B. | 比4He少一个中子 | C. | 是4He的同位素 | D. | 与4He质子数相同 |
 有机化合物的化学性质本质上就是分子结构中所含官能团的性质:
有机化合物的化学性质本质上就是分子结构中所含官能团的性质: ;
; 乙
乙 丙
丙

 )
)