题目内容
【题目】按要求填空
(1)化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知:N≡N键的键能是948.9kJmol﹣1 , H﹣H键的键能是436.0kJmol﹣1;由N2和H2合成1mol NH3时可放出46.2kJ的热量.N﹣H键的键能是
(2)由氢气和氧气反应生成1mol水蒸气,放热241.8KJ.写出该反应的热化学方程式:① .
已知常温下NO与O2反应生成1molNO2的焓变为﹣57.07KJ,1molNO2与H2O反应生成HNO3溶液和NO的焓变为﹣46KJ,写出NO与O2及水生成HNO3溶液的热化学方程式② .
(3)某温度下纯水中的c(H+)=2×10﹣7mol/L,则此时c(OH﹣)=mol/L,该纯水的pH(填“>7”、“<7”、“=7”).若温度不变,滴入稀硫酸使c(H+)=5×10﹣6mol/L,则c(OH﹣)=mol/.
(4)纳米MgO可用于尿素与氯化镁合成.某小组研究该反应在温度为378~398K时的反应时间、反应物配比等因素对其产率的影响.请完成以下实验设计表:
编号 | 温度/K | 反应时间/h | 反应物物质的量配比 | 实验目的 |
① | 378 | 3 | 3:1 | 实验②和④探究 |
② | 378 | 4 | 4:1 | |
③ | 378 | 3 | ||
④ | 398 | 4 | 4:1 |
【答案】
(1)391.6kJ?mol﹣1
(2)H2(g)+ ![]() O2(g)═H2O(g)△H=﹣241.8kJ/mol;4NO(g)+3O2(g)+2H2O(g)=4HNO3(aq)△H=﹣618.42KJ/mol
O2(g)═H2O(g)△H=﹣241.8kJ/mol;4NO(g)+3O2(g)+2H2O(g)=4HNO3(aq)△H=﹣618.42KJ/mol
(3)2×10﹣7;<7;8×10﹣9
(4)温度对产率的影响;4:1;③
【解析】解:(1)据题意,0.5mol氮气和1.5mol氢气反应生成1mol氨气时放出46.2KJ的热量,又△H=反应物的键能﹣生成物的键能,1mol氨气中有3molN﹣H键,设其键能为x,则有0.5×948.9+1.5×436.0﹣3x=﹣46.2,
可解得x=391.6,所以N﹣H键的键能为391.6kJ/mol,
所以答案是:391.6 kJmol﹣1;
(2.)氢气和氧气反应生成1mol水蒸气放热241.8kJ,该反应的热化学方程式为:H2(g)+ ![]() O2(g)═H2O(g)△H=﹣241.8kJ/mol,常温下NO与O2反应生成1molNO2的焓变为﹣57.07KJ,热化学方程式为:NO(g)+
O2(g)═H2O(g)△H=﹣241.8kJ/mol,常温下NO与O2反应生成1molNO2的焓变为﹣57.07KJ,热化学方程式为:NO(g)+ ![]() O2(g)=NO2(g)△H=﹣57.07KJ/mol ①,1molNO2与H2O反应生成HNO3溶液和NO的焓变为﹣46KJ,NO2(g)+
O2(g)=NO2(g)△H=﹣57.07KJ/mol ①,1molNO2与H2O反应生成HNO3溶液和NO的焓变为﹣46KJ,NO2(g)+ ![]() H2O(l)=
H2O(l)= ![]() HNO3(aq)+
HNO3(aq)+ ![]() NO(g),△H=﹣46KJ/mol ②,依据盖斯定律(①+②)×6得到热化学方程式:4NO(g)+3O2(g)+2H2O(g)=4HNO3(aq)△H=﹣618.42KJ/mol,
NO(g),△H=﹣46KJ/mol ②,依据盖斯定律(①+②)×6得到热化学方程式:4NO(g)+3O2(g)+2H2O(g)=4HNO3(aq)△H=﹣618.42KJ/mol,
所以答案是:H2(g)+ ![]() O2(g)═H2O(g)△H=﹣241.8kJ/mol,4NO(g)+3O2(g)+2H2O(g)=4HNO3(aq)△H=﹣618.42KJ/mol;
O2(g)═H2O(g)△H=﹣241.8kJ/mol,4NO(g)+3O2(g)+2H2O(g)=4HNO3(aq)△H=﹣618.42KJ/mol;
(3.)纯水中 C(OH﹣)=C(H+)=2×10﹣7 mol/L Kw=C(H+)C(OH﹣)=2×10﹣7×2×10﹣7=4×10﹣14 , 水呈中性,PH<7,若温度不变,滴入稀硫酸使c(H+)=5×10﹣6mol/L,C(OH﹣)= ![]() =
= ![]() =8×10﹣9 mol/L,
=8×10﹣9 mol/L,
所以答案是:2×10﹣7 , <7,8×10﹣9;
(4.)实验根据控制变量法进行对比试验,研究温度、反应时间、反应物配比对氧化镁产率的影响.
实验①和③,温度相同,反应时间相同,应研究反应物配比对氧化镁产率的影响,③中反应物配比应为4:1;
实验②和④,反应时间相同,反应物配比相同,温度不同,应是探究温度对产率的影响;
③中反应物配比应为4:1,实验②和③,温度相同、反应物配比相同,反应时间不同,探究反应时间对产率的影响.
所以答案是:4:1;温度对产率的影响;③;
【考点精析】利用反应热和焓变对题目进行判断即可得到答案,需要熟知在化学反应中放出或吸收的热量,通常叫反应热.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO47H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%). 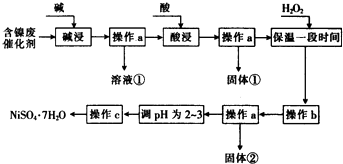
部分阳离子以氢氧化物形式沉淀时的pH如下:
沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
Al(OH)3 | 3.8 | 5.2 |
Fe(OH)3 | 2.7 | 3.2 |
Fe(OH)2 | 7.6 | 9.7 |
Ni(OH)2 | 7.1 | 9.2 |
(1)“碱浸”过程中发生反应的离子方程式是
(2)“酸浸”时所加入的酸是(填化学式).
(3)加入H2O2时发生反应的离子方程式为
(4)操作b为调节溶液的pH,你认为pH的调控范围是
(5)产品晶体中有时会混有少量绿矾(FeSO47H2O),其原因可能是(写出一点即可).
(6)NiS047H2O可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为 .
【题目】向2.0L恒容密闭容器中充入1.0mol PCl5 , 在温度为T时发生如下反应PCl5(g)PCl3(g)+Cl2(g)△H=+124kJmol﹣1 . 反应过程中测定的部分数据见下表:
时间t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
回答下列问题:
(1)反应在前50s的平均速率v(PCl5)= , 该反应的△S0(填“<”、“>”或“=”).
(2)温度为T时,该反应的化学平衡常数= .
(3)上述反应到达平衡状态时,PCl3的体积分数为 .
要提高平衡时PCl3的体积分数,可采取的措施有 .
A.温度不变,压缩容器体积增大压强 B.使用高效催化剂
C.温度和体积不变,减小PCl5的起始量 D.体积不变,提高反应温度
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a= .
(5)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),该反应的化学方程式是 .