题目内容
10.短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )| A. | 元素X的简单气态氢化物的热稳定性比W的弱 | |
| B. | 元素W的最高价氧化物对应水化物的酸性比Z的弱 | |
| C. | 化合物YX、ZX2、WX3中化学键的类型相同 | |
| D. | 原子半径的大小顺序:Y>Z>W>X |
分析 短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,X有2个电子层,最外层电子数为6,故X为O元素,W与X属于同一主族,故W为S元素,Y原子的最外层只有2个电子,原子序数大于O元素,故Y处于第三周期,故Y为Mg元素,Z单质可制成半导体材料,Z为Si元素.
解答 解:短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,X有2个电子层,最外层电子数为6,故X为O元素,W与X属于同一主族,故W为S元素,Y原子的最外层只有2个电子,原子序数大于O元素,故Y处于第三周期,故Y为Mg元素,Z单质可制成半导体材料,Z为Si元素,
A.非金属性O>S,故元素O的气态氢化物的热稳定性比S的强,故A错误;
B.非金属Si<S,故元素S的最高价氧化物对应水化物的酸性比Si的强,故B错误;
C.化合物MgO为离子化合物,含有离子键,SiO2、SO3属于共价化合物,含有共价键,故C错误;
D.同周期自左而右,原子半径减小,同主族电子层越多原子半径越大,故原子半径Mg>Si>S>O,即Y>Z>W>X,故D正确,
故选:D.
点评 本题考查结构性质与位置关系、元素周期律等,难度不大,推断元素是解题的关键,注意对基础知识的全面掌握.

练习册系列答案
相关题目
19.双酚A也称BPA(结构如图所示),严重威胁着胎儿和儿童的健康,甚至癌症和新陈代谢紊乱导致的肥胖也被认为与此有关.下列关于双酚A的说法正确的是( )
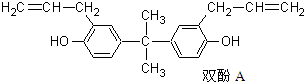

| A. | 该化合物的化学式为C20H24O2 | |
| B. | 该化合物与三氯化铁溶液反应显紫色 | |
| C. | 该化合物的所有碳原子处于同一平面 | |
| D. | 1mol双酚A最多可与4mol Br2发生取代反应 |
1.下列实验操作及现象能够达到实验目的是( )
| 选项 | 实验操作及现象 | 实验目的 |
| A | 溶液中滴加盐酸酸化的氯化钡溶液出现白色沉淀 | 检验溶液中存在SO42- |
| B | FeBr2溶液加入少量氯水,溶液有浅绿色变为黄色 | 比较Fe2+、Br-还原性强弱 |
| C | 向一定浓度Na2SiO3溶液中通CO2,溶液变浑浊 | 比较C、Si非金属性强弱 |
| D | 溶液中加KSCN溶液,再加氯水,观察溶液是否出现血红色 | 检验Fe3+溶液中是否含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
18.雷雨天闪电时空气中有臭氧(O3)生成,下列说法正确的是( )
| A. | O2和O3互为同位素 | |
| B. | 在相同的温度与压强下,等体积的O2和O3含有相同的分子数 | |
| C. | 等物质的量的O2和O3含有相同的质子数 | |
| D. | O2和O3的相互转化是物理变化 |
5.从沸腾炉出来的炉气必须净化的原因是( )
| A. | 增加SO2的体积百分比浓度 | |
| B. | 防止矿尘阻塞管道 | |
| C. | 防止催化剂中毒,防止水蒸气跟SO2、SO3结合腐蚀设备 | |
| D. | 炉气中含有的大量N2必须除去 |
15.不粘锅是在普通锅的内侧涂覆上一层树脂而成,这层树脂的主要成分是聚四氟乙烯.洗衣店干洗西装是用有机溶剂来洗衣服的,目前使用的标准干洗剂的主要成分是四氯乙烯.关于聚四氟乙烯和四氯乙烯,下面的说法正确的是( )
| A. | 它们都是乙烯的同系物 | B. | 它们都属于混合物 | ||
| C. | 它们的分子中都含有C=C双键 | D. | 它们分子中都不含氢原子 |
2.关于有机物的下列说法,不正确的是( )
| A. | 石油裂解能得到乙烯,乙烯是生产聚乙烯的原料 | |
| B. | 丙烷、丙烯都属于烃,都有同分异构体 | |
| C. | 葡萄糖可转化为乙醇,乙醇氧化可得到乙醛 | |
| D. | 煤干馏为化学变化,石油分馏是物理变化 |
19. 下表是某超市出售的加碘食盐的有关说明:
下表是某超市出售的加碘食盐的有关说明:
某研究性学习小组欲通过实验检验该碘盐中是否含碘:
(1)首先取该食盐样品配制室温下的饱和溶液:向200mL蒸馏水中加入75.0g 该食盐样品,加热并搅拌,直到完全溶解.冷却至室温.(已知室温条件下氯化钠溶解度为36g)
在加热过程中需要用到的仪器有铁架台、酒精灯、铁圈、石棉网、烧杯和玻璃棒.冷却至室温过程中若出现固体析出(填现象),则证明其为饱和溶液.
(2)甲同学先向该饱和食盐溶液中加入1mol/L的KI溶液和几滴淀粉溶液,然后加乳入0.1mol/L稀硫酸,振荡,溶液变为蓝色.该实验发生的化学反应中氧化剂与还原剂的物质的量之比为1:5.请在图中画出参加反应的IO3-的物质的量和析出的I2单质的物质的量的关系曲线.
(3)乙同学认为甲同学的实验方案不严谨,他提出如下假设:空气中的氧气可能参与反应,使溶液变蓝.反应的离子方程式为:O2+4I-+4H+=2I2+2H2O.请你设计实验方案验证乙同学的假设是否正确:向1mol/L的KI溶液中加入0.1mol/L稀硫酸和几滴淀粉溶液,振荡,若溶液变为蓝色,则乙同学的假设正确.
 下表是某超市出售的加碘食盐的有关说明:
下表是某超市出售的加碘食盐的有关说明:| 配 料 表 | 精制盐、碘酸钾 |
| 含 碘 量 | 45±5mg/kg |
| 储 藏 方 法 | 通风、防潮 |
| 食 用 方 法 | 根据烹调所需适量加入 |
(1)首先取该食盐样品配制室温下的饱和溶液:向200mL蒸馏水中加入75.0g 该食盐样品,加热并搅拌,直到完全溶解.冷却至室温.(已知室温条件下氯化钠溶解度为36g)
在加热过程中需要用到的仪器有铁架台、酒精灯、铁圈、石棉网、烧杯和玻璃棒.冷却至室温过程中若出现固体析出(填现象),则证明其为饱和溶液.
(2)甲同学先向该饱和食盐溶液中加入1mol/L的KI溶液和几滴淀粉溶液,然后加乳入0.1mol/L稀硫酸,振荡,溶液变为蓝色.该实验发生的化学反应中氧化剂与还原剂的物质的量之比为1:5.请在图中画出参加反应的IO3-的物质的量和析出的I2单质的物质的量的关系曲线.
(3)乙同学认为甲同学的实验方案不严谨,他提出如下假设:空气中的氧气可能参与反应,使溶液变蓝.反应的离子方程式为:O2+4I-+4H+=2I2+2H2O.请你设计实验方案验证乙同学的假设是否正确:向1mol/L的KI溶液中加入0.1mol/L稀硫酸和几滴淀粉溶液,振荡,若溶液变为蓝色,则乙同学的假设正确.
20.下列关于物质性质变化的比较,不正确的是( )
| A. | 非金属性强弱:I>Br>Cl | B. | 原子半径大小:Na>P>S | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 金属性强弱:Na>Mg>Al |