题目内容
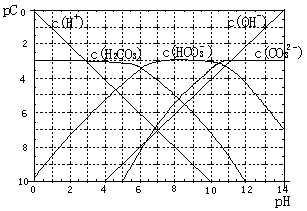 pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值,如溶液中某溶质的浓度为:1×10-3mol·L-1,则pC=-lg(1×10-3)=3。H2CO3溶液的pC-pH关系如图。
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值,如溶液中某溶质的浓度为:1×10-3mol·L-1,则pC=-lg(1×10-3)=3。H2CO3溶液的pC-pH关系如图。
请回答下列问题:
(1)pH=2~4时,H2CO3溶液中主要存在的离子为 。
(2)已知碳酸溶液中存在平衡:H2O+CO2 H2CO3
H2CO3 H++HCO3-。当溶液pH由5减小到0时,溶液中H2CO3的pC基本不变的原因是
H++HCO3-。当溶液pH由5减小到0时,溶液中H2CO3的pC基本不变的原因是
。
(3)能够抵抗外来少量酸碱的影响、保持自身 pH变化不大的溶液,称之为缓冲溶液。如浓度均为0.1mol·L-1的NaHCO3和Na2CO3混合溶液就是一种缓冲溶液,加入少量酸或碱,由于平衡HCO3- H++CO32-移动,溶液中H+浓度变化不大。根据上述信息,下列不能形成缓冲溶液的是
。
H++CO32-移动,溶液中H+浓度变化不大。根据上述信息,下列不能形成缓冲溶液的是
。
A.碳酸钠和氢氧化钠的混和溶液 B.醋酸和醋酸钠的混和溶液
C.硫酸和硫酸钠的混合溶液 D.氨水和氯化铵的混和溶液
【答案】
(1)H+、HCO3- (2分)
(2)溶液中H+浓度增大时,平衡H++HCO3- H2CO3
H2CO3 H2O+CO2向右移动,由于CO2溶解度小,生成的CO2会逸出,故H2CO3浓度基本不变(2分)
H2O+CO2向右移动,由于CO2溶解度小,生成的CO2会逸出,故H2CO3浓度基本不变(2分)
(3)A、C (2分)

练习册系列答案
相关题目
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol?L-1,则该溶液中溶质的pC=3.下列表达正确的是( )
| A、某温度下任何电解质的水溶液中,pC(H+)+pC(OH-)=14 | B、0.01mol/L的CaCl2溶液中逐渐滴加纯碱溶液,滴加过程中pC(Ca2+)逐渐减小 | C、用0.01mol/L的盐酸滴定某浓度的NaOH溶液,滴定过程中pC(H+)逐渐增大 | D、某温度下,AB难溶性离子化合物的Ksp=1.0×10-10,其饱和溶液中pC(A+)+pC(B-)=10 |
 pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为1×10-3mol/L,则溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为1×10-3mol/L,则溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡: 此条件下,该反应达到化学平衡时,氮气的浓度为
此条件下,该反应达到化学平衡时,氮气的浓度为
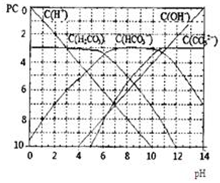 pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中溶质的pC=-lg1×10-3=3.图为H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图.请回答下列问题:
pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中溶质的pC=-lg1×10-3=3.图为H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图.请回答下列问题: