题目内容
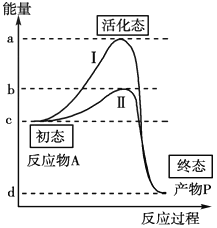
【题目】顺﹣1,2﹣二甲基环丙烷和反﹣1,2﹣二甲基环丙烷可发生如图1转化:
该反应的速率方程可表示为:v(正)=k(正)c(顺)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正,逆反应速率常数.回答下列问题:
(1)已知:t1温度下,k(正)=0.006s﹣1 , k(逆)=0.002s﹣1 , 该温度下反应的平衡常数值K1=;该反应的活化能Ea(正)小于Ea(逆),则△H0(填“小于”“等于”或“大于”).
(2)t2温度下,图2中能表示顺式异构体的质量分数随时间变化的曲线是(填曲线编号),平衡常数值K2=;温度t1t2(填“小于”“等于”或“大于”),判断理由是 .
【答案】
(1)3;小于
(2)B;![]() ;小于;放热反应升高温度时平衡向逆反应方向移动
;小于;放热反应升高温度时平衡向逆反应方向移动
【解析】(1)根据v(正)=k(正)c(顺),k(正)=0.006s﹣1 , 则v(正)=0.006c(顺),v(逆)=k(逆)c(反),k(逆)=0.002s﹣1 , 则v(逆)=0.002c(反),化学平衡状态时正逆反应速率相等,则0.006c(顺)=0.002c(反),该温度下反应的平衡常数值K1= ![]() =
= ![]() =3,该反应的活化能Ea(正)小于Ea(逆),说明断键吸收的能量小于成键释放的能量,即该反应为放热反应,则△H小于0, 所以答案是:3; 小于;
=3,该反应的活化能Ea(正)小于Ea(逆),说明断键吸收的能量小于成键释放的能量,即该反应为放热反应,则△H小于0, 所以答案是:3; 小于;
(2)随着时间的推移,顺式异构体的质量分数不断减少,则符合条件的曲线是B,设顺式异构体的起始浓度为x,则可逆反应左右物质的系数相等,均为1,则平衡时,顺式异构体为0.3想,反式异构体为0.7x,所以平衡常数K2= ![]() =
= ![]() ,因为K1>K2 , 放热反应升高温度时平衡逆向移动,所以温度t2>t1 , 所以答案是:B;
,因为K1>K2 , 放热反应升高温度时平衡逆向移动,所以温度t2>t1 , 所以答案是:B; ![]() ;小于;放热反应升高温度时平衡向逆反应方向移动.
;小于;放热反应升高温度时平衡向逆反应方向移动.
【考点精析】关于本题考查的化学平衡常数的含义和化学平衡状态本质及特征,需要了解指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度不变的状态;化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能得出正确答案.

【题目】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大,部分元素在周期表中的位置关系如右图所示.其中X是周期表中原子半径最小的元素,Q与X同主族;Z的最外层电子数是次外层的3倍.
Y | Z | ||
R |
请回答下列问题:
(1)写出Y元素的名称: , Q的原子结构示意图;R在周期表中的位置为 .
(2)Q2Z电子式为: , Q2Z2含的化学键类型为: .
(3)R、Z分别形成简单离子的半径大小:(离子符号表示)
(4)Y的氢化物与其最高价氧化物对应的水化物反应的化学方程式为: .