题目内容
18.(1)在N2、NH3、NH4+、H2O、H3O+、ICl、SO42-中,含有配位键的微粒有NH4+、H3O+;(2)利用价层电子对数判断分子的空间构型的方法判断如下:CO32-、SO32-、NO2和ClO4-的空间构型分别是平面三角形、三角锥形、V形和正四面体型.
分析 (1)在物质或离子中中心原子含有空轨道,和含有孤电子对的原子或离子能形成配位键;
(2)先计算其价层电子对,再根据VSEPR模型分子或离子构型,根据价层电子对互斥理论确定其空间构型,价层电子对个数=σ键个数+孤电子对个数,据此分析解答.
解答 解:(1)N2结中含有一个σ键和两个π键结构简式为:N≡N,氮气分子中氮原子含有孤电子对,不含空轨道,所以不含有配位键;
氨气的电子式为 ,氨气分子中氮原子含有孤电子对,但氢原子不含空轨道,所以不含有配位键;
,氨气分子中氮原子含有孤电子对,但氢原子不含空轨道,所以不含有配位键;
氨气分子中氮原子含有孤电子对,氢离子提供空轨道,可以形成配位键,NH4+含有配位键;
H2O是共价化合物,是由原子和氢原子形成共价键,电子式为 ,不含空轨道,所以不含有配位键;
,不含空轨道,所以不含有配位键;
H3O+中O提供孤电子对,H+提供空轨道,二者形成配位键,H3O+含有配位键;
ICl是共价化合物,碘、氯都含有孤电子对,但不含空轨道,所以不含有配位键;
SO42-中,硫原子和氧原子形成4个共价键,带2个单位的负电荷,所以含孤电子对数为0,所以不含有配位键;
故答案为:NH4+、H3O+;
(2)CO32-中孤对电子$\frac{4+2-3×2}{2}$=0,价层电子对个数=3+0=3,则C采取sp2杂化,空间构型为平面三角形;
SO32-价层电子对个数=3+$\frac{6+2-3×2}{2}$=4,S原子采取sp3杂化,含孤电子对数为1,SO32-空间构型为三角锥形,
NO2的氮外围有五个单电子,其中四个分成两对分别与氧外围的两个电子成键,形成一个共价π键,此外,但还有一个单电子,此电子无法成键,由于只有两个配位原子,17℃以下经常是两个分子结合在一起,所以空间构型为V形;
ClO4-离子中价层电子对个数=σ键个数+孤电子对个数=4+0=4,中心原子外围有四个原子所以不含有孤电子对,即ClO4-为正四面体结构,
故答案为:平面三角形;三角锥形;V形;正四面体型.
点评 本题考查配位键的形成条件及其应用、分子中原子采取的杂化方式等,题目难度中等,需要学生全面掌握配位键的形成条件,并能运用分析解决问题,注意配位键形成的条件,一方要提供空轨道,另一方提供孤电子对,根据VSEPR理论预测分子或离子的空间构型是学习的重点,也是近几年高考的热点.

| A. | 常温下0.4 mol/L HB溶液和0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)>c(H+)>c(Na+)>c(OH-) | |
| B. | 同浓度同体积的NaClO溶液和CH3COONa溶液,离子总数前者小于后者 | |
| C. | 在1mol/L CH3COOH溶液中加入少量冰醋酸,醋酸的电离平衡正向移动且电离程度增大 | |
| D. | 常温下0.1 mol/L的下列溶液①NH4Al(SO4)2;②NH4Cl;③NH3•H2O;④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③ |
| A. | 16 g | B. | 32 g | C. | 16g/mol | D. | 32 g/mol |
| A. | 它的最外层电子数为5 | B. | 它的金属性比铅强 | ||
| C. | 它具有+2、+3、+4价 | D. | 它的最高价氧化物的水化物是强酸 |
| A. | 1.0L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 1 mol硝基与1 moL NO2所含电子数不相同 | |
| C. | 1L pH=13的NaOH溶液中含有OH-的数目一定为0.1 NA | |
| D. | 12g金刚石中含有C-C键数目为2NA |
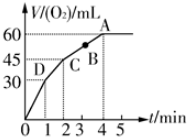
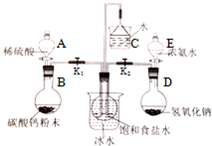 某课外活动小组模拟工业制备纯碱,方案如下:
某课外活动小组模拟工业制备纯碱,方案如下: