题目内容
【题目】某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:
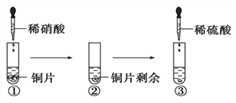
下列说法正确的是
A. ①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2
B. ②中溶液存在:c(Cu2+) + c(H+) = c(NO3-) + c(OH-)
C. 由上述实验得出结论:常温下,Cu既可与稀硝酸反应,也可与稀硫酸反应
D. ③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4 === 4CuSO4 +2NO↑+4H2O
【答案】D
【解析】A、①中发生3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,生成硝酸铜溶液为蓝色,试管口NO被氧化生成红棕色的NO2,但硝酸被还原生成NO,选项A错误;B、②中溶液为硝酸和硝酸铜的混合溶液,根据电荷守恒,存在:2c(Cu2+) + c(H+) = c(NO3-) + c(OH-),选项B错误;C、由上述实验可得出结论:常温下,Cu既可与稀硝酸反应,选项C错误;D、实验③中反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4═4CuSO4+2NO↑+4H2O,选项D正确。答案选D。

练习册系列答案
相关题目
【题目】下列有关混合物、纯净物、电解质、非电解质的正确组合为( )
选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
A | 盐酸 | 水煤气 | 硫酸 | 干冰 |
B | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
C | 胆矾 | 氢氧化铁胶体 | 铁 | 碳酸钙 |
D | 水银 | 澄清石灰水 | 氯化铜 | 碳酸钠 |
A.A
B.B
C.C
D.D