题目内容
15.下列离子方程式正确的是( )| A. | 碳酸钙加入盐酸中:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 铁片加入CuSO4溶液中:2Fe+3Cu2+═3Cu+2Fe3+ | |
| C. | 稀硫酸加入氢氧化钡溶液 2H++SO42-+Ba2++2OH-═BaSO4↓+H2O | |
| D. | 氯化铜溶液中加入NaOH溶液:Cu2++OH-═Cu(OH)2↓ |
分析 A.反应生成氯化钙、水、二氧化碳;
B.反应生成硫酸亚铁和Cu;
C.H、O原子不守恒;
D.反应生成氢氧化铜和氯化钠,电荷不守恒.
解答 解:A.碳酸钙加入盐酸中的离子反应为CaCO3+2H+═Ca2++CO2↑+H2O,故A正确;
B.铁片加入CuSO4溶液中的离子反应为Fe+Cu2+═Cu+Fe2+,故B错误;
C.稀硫酸加入氢氧化钡溶液的离子反应为2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故C错误;
D.氯化铜溶液中加入NaOH溶液的离子反应为Cu2++2OH-═Cu(OH)2↓,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
10.组成中有氢氧根的盐叫做碱式盐,酸根中含有氢元素的盐叫做酸式盐下列盐中属于碱式盐的是( )
| A. | KHSO4 | B. | Cu2(OH)2CO3 | C. | Ca(H2PO4)2 | D. | NH4NO3 |
2.下列变化中,不需要破坏化学键的是( )
| A. | NO与O2反应 | B. | 碘加热升华 | C. | 氯酸钾加热分解 | D. | 氯化钠溶于水 |
 、C3+ 三种金属阳离子的水溶液发生了如下一系列变化:
、C3+ 三种金属阳离子的水溶液发生了如下一系列变化: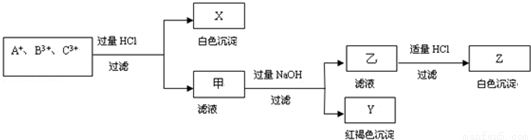

 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂. ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.