题目内容
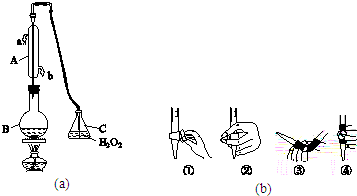
3.除去氯化钾固体中混有的少量氯化钡杂质,应先加入K2CO3(填化学式),再向过滤后的滤液中加入过量的稀盐酸(填试剂名称),最后蒸发结晶.反应的离子方程式依次是Ba2++CO32-=BaCO3↓;2H++CO32-=CO2↑+H2O.分析 除去氯化钡,选择碳酸钾,然后加盐酸除去过量的碳酸钾,以此来解答.
解答 解:除去氯化钾固体中混有的少量氯化钡杂质,应先加入K2CO3,发生Ba2++CO32-=BaCO3↓,再向过滤后的滤液中加入过量的稀盐酸除去碳酸钾,发生2H++CO32-=CO2↑+H2O,最后蒸发结晶,
故答案为:K2CO3;稀盐酸;Ba2++CO32-=BaCO3↓;2H++CO32-=CO2↑+H2O.
点评 本题考查混合物的分离提纯,为高频考点,把握物质的性质及性质差异为解答的关键,侧重分析与应用能力的考查,注意发生的反应,题目难度不大.

练习册系列答案
相关题目
14.根据相应的图象(图象编号与答案一一对应),判断下列相关说法正确的是( )
| A. | 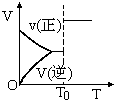 aX(g)+bY(g)?cZ(g)密闭容器中反应达平衡,T0时条件改变如图所示,则改变的条件一定是加入催化剂 | |
| B. |  L(s)+aG(g)?bR(g)反应达到平衡时,外界条件对平衡影响如图所示,若P1>P2,则a>b | |
| C. | 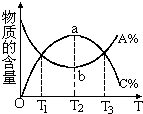 aA+bB?cC物质的百分含量和温度关系如图所示,则该反应的正反应为放热反应 | |
| D. | 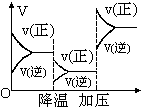 A+2B?2C+3D反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A、B、C是气体、D为固体或液体 |
11.关于钠元素的单质及其化合物的叙述正确的是( )
| A. | 金属钠长期置于空气中,最终变成Na2O2 | |
| B. | 钠可从硫酸铜溶液中置换出铜 | |
| C. | Na2O和Na2O2都是碱性氧化物 | |
| D. | Na2O2中过氧根离子O22-的摩尔质量是32g•mol-1 |
18.在上海召开的第七届全球人类基因大会上,我国科学家第一次提出可以用砒霜(As2O3)来治疗早期幼粒白血病.已知砒霜具有两性.已知如下转化关系:
As2O3+Zn+H2SO4-→AsH3+ZnSO4+H2O,As2O3在上述反应中显示出来的性质是 ( )
As2O3+Zn+H2SO4-→AsH3+ZnSO4+H2O,As2O3在上述反应中显示出来的性质是 ( )
| A. | 氧化性 | B. | 还原性 | C. | 酸性 | D. | 碱性 |
15.下列离子方程式正确的是( )
| A. | 碳酸钙加入盐酸中:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 铁片加入CuSO4溶液中:2Fe+3Cu2+═3Cu+2Fe3+ | |
| C. | 稀硫酸加入氢氧化钡溶液 2H++SO42-+Ba2++2OH-═BaSO4↓+H2O | |
| D. | 氯化铜溶液中加入NaOH溶液:Cu2++OH-═Cu(OH)2↓ |
12.由硫酸钾、硫酸铝和硫酸组成的混合溶液,其c(H+)=0.1mol•L-1,c(K+)=0.6mol•L-1,c( SO42-)=0.8mol•L-1,则c(Al3+)为( )
| A. | 0.1 mol•L-1 | B. | 0.3mol•L-1 | C. | 0.6mol•L-1 | D. | 0.9mol•L-1 |