题目内容
10.将117g NaCl溶于水配制成1L溶液,(1)该溶液中NaCl的物质的量浓度为2mol/L,溶液中Cl-的物质的量浓度为2mol/L.
(2)配制1mol•L-1的NaCl溶液500mL,需该溶液的体积为0.25L.
(3)向该溶液中再通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3mol•L-1(假设溶液体积不变),则溶液中H+的物质的量浓度为1mol/L,通入HCl气体的体积(标准状况下)为22.4L.
分析 (1)依据C=$\frac{n}{V}$=$\frac{\frac{m}{M}}{V}$计算氯化钠溶液的物质的量浓度,氯化钠为强电解质完全电离所以溶液中存在n(Cl-)=n(NaCl),C(Cl-)=C(NaCl);
(2)依据溶液稀释前后所含溶质的物质的量不变计算需要浓溶液的体积;
(3)溶液中溶质为NaCl、HCl,根据电荷守恒c(Na+)+c(H+)=c(Cl-),据此计算溶液在c(H+),而c(HCl)=c(H+),根据c=nV计算n(HCl),再根据V=nVm计算通入HCl的体积.
解答 解:(1)将117g NaCl溶于水配制成1L溶液,该溶液中NaCl的物质的量浓度为C=$\frac{n}{V}$=$\frac{\frac{m}{M}}{V}$=$\frac{\frac{117g}{58.5g}}{1L}$=2mol/L;氯化钠为强电解质完全电离所以溶液中存在n(Cl-)=n(NaCl),C(Cl-)=C(NaCl)=2mol/L;
故答案为:2mol/L;2mol/L;
(2)设配制1mol•L-1的NaCl溶液500mL,需要2mol/L氯化钠溶液体积为V,依据溶液稀释前后所含溶质的物质的量不变,1mol•L-1×0.5L=2mol/L×V,
解得V=0.25L;
故答案为:0.25L;
(3)溶液中溶质为NaCl、HCl,根据电荷守恒c(Na+)+c(H+)=c(Cl-),溶液中c(Na+)=2mol/L,c(Cl-)=3mol/L,则c(H+)=3mol/L-2mol/L=1mol/L,而c(HCl)=c(H+)=1mol/L,故n(HCl)=1L×1mol/L=1mol,故通入HCl的体积=1mol×22.4L/mol=22.4L.
故答案为:22.4L.
点评 本题考查物质的量浓度有关计算,熟悉溶液中溶质与离子个数之间的关系、溶液中存在的电荷守恒是解题关键,题目难度不大.

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案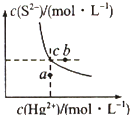 硫化汞(HgS)难溶于水,在自然界中呈红褐色,常用于油画颜料、印泥及朱红雕刻漆器等.某温度时,HgS在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
硫化汞(HgS)难溶于水,在自然界中呈红褐色,常用于油画颜料、印泥及朱红雕刻漆器等.某温度时,HgS在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )| A. | 向硫化汞的浊液中加入硫化钠溶液,硫化汞的Ksp减小 | |
| B. | 图中a点对应的是饱和溶液 | |
| C. | 向c点的溶液中加入Hg(NO3)2,则c(S2-)减小 | |
| D. | 升高温度可以实现c点到b点的转化 |
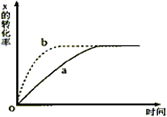 如图曲线a表示放热反应2X(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系,若要改变起始条件,使反应过程按b曲线进行,不可采取的措施是( )
如图曲线a表示放热反应2X(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系,若要改变起始条件,使反应过程按b曲线进行,不可采取的措施是( )| A. | 升高温度 | B. | X的投入量增加 | C. | 加催化剂 | D. | 减小容器体积 |
| A | B | C | D | |
| 阳极 | 蓝 | 白 | 红 | 蓝 |
| 阴极 | 白 | 蓝 | 蓝 | 蓝 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 标准状况下,1mol任何物质的体积都约为22.4L | |
| B. | 1mol任何气体所含分子数都相同,体积也都约为22.4L | |
| C. | 同温同压下,相同体积的任何气体单质所含原子数目相同 | |
| D. | 常温常压下0.3mol H2、0.7mol N2组成的混合气体共含有NA个分子 |
| A. | 浓硝酸和稀硝酸都具有氧化性 | B. | 铜与硝酸的反应属于置换反应 | ||
| C. | 金属与硝酸反应不产生氢气 | D. | 可用铁或铝制品盛装浓硝酸 |
| A. | 任何物质燃烧都必须有氧气参加 | |
| B. | 氢气在氯气中燃烧发出淡蓝色火焰,并在空气中产生大量白雾 | |
| C. | 饱和氯水在光照下有气泡产生,该气体为氯气 | |
| D. | 长久放置的氯水将失去漂白性 |
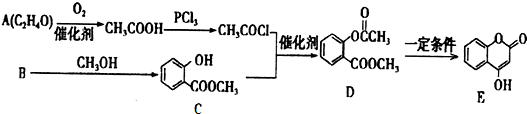
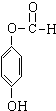
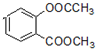 +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+ +H2O.
+H2O.