题目内容
【题目】(1)检测人的血液中葡萄糖(简称血糖,相对分子质量为180)的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL)。以“mmol/L”表示时,人的血糖正常值为3.61~6.11mmol/L之间。如果以“mg/dL”表示,若某人的血糖检测结果是92mg/dL,他的血糖正常吗_____________(填正常或不正常)
(2)某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,在方框和括号内填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实验方案______。

(3)如图,验证牺牲阳极的阴极保护法时,往Fe电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液,观察烧杯内溶液颜色有无变化.请回答:

①.电压表指针有何变化_________原因是_______________________
②.请写出Fe2+与[Fe(CN)6]3反应的离子方程式:____________________
(4)K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]![]() 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为__________________。
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为__________________。
【答案】正常  发生偏转 因为有电流产生 3Fe2++2[Fe(CN)6]3=Fe3[Fe(CN)6]2↓ 3FeC2O4+2K3[Fe(CN)6]
发生偏转 因为有电流产生 3Fe2++2[Fe(CN)6]3=Fe3[Fe(CN)6]2↓ 3FeC2O4+2K3[Fe(CN)6]![]() Fe3[Fe(CN)6]2+3K2C2O4
Fe3[Fe(CN)6]2+3K2C2O4
【解析】
(1)根据物质的量浓度概念以及物质的量和质量之间的关系解答;
(2)依据本题要求,应用如图所示流程图,欲回收硫酸亚铁和铜,结合图中提示分析可得结论;
(3)该装置是原电池,锌易失电子作负极,铁作正极,亚铁离子和铁氰化钾溶液能产生蓝色沉淀,据此解答;
(4)发生显色反应的是Fe2+和K3[Fe(CN)6]反应生成Fe3[Fe(CN)6]2。
(1)1mmol=10-3mol、1g=103mg、1L=10dL,故3.61mmol糖质量为:3.61![]() -3 mol×180mg/mol=649.80mg,用 mg/dL表示血糖浓度为:
-3 mol×180mg/mol=649.80mg,用 mg/dL表示血糖浓度为:![]() =64.98mg/dL;
=64.98mg/dL;
6.11mmol,血糖的质量为:6.11×10-3mol×180mg/mol=1099.80mg,用 mg/dL表示血糖浓度为:![]() = 109.98mg/dL,故血糖正常取值范围是64.98109.98mg/dL,由于此人血糖在这个范围之内,所以正常;
= 109.98mg/dL,故血糖正常取值范围是64.98109.98mg/dL,由于此人血糖在这个范围之内,所以正常;
本题答案为:正常
(2)废水中加入过量的铁粉,过滤,得到固体为铁和铜的混合物,滤液为硫酸亚铁。再往得到的固体混合物中加入稀硫酸,铁溶解,过滤后得到固体铜,此时滤液为硫酸亚铁;对所得滤液硫酸亚铁,进行蒸发结晶操作,得到带7个结晶水的硫酸亚铁晶体;
本题答案为: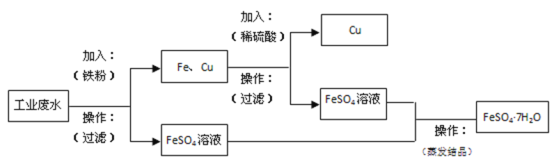
(3)该装置是原电池,锌易失电子作负极,铁作正极,故电压表指针发生偏转,亚铁离子和铁氰化钾溶液能产生蓝色沉淀,离子方程式为:3Fe2++2[Fe(CN)6]3=Fe3[Fe(CN)6]2↓;
本题答案为:发生偏转,因为有电流产生;3Fe2++2[Fe(CN)6]3=Fe3[Fe(CN)6]2↓。
(4)发生显色反应的是Fe2+和K3[Fe(CN)6]反应生成Fe3[Fe(CN)6]2。化学方程式为:3FeC2O4+2K3[Fe(CN)6]![]() Fe3[Fe(CN)6]2+3K2C2O4;
Fe3[Fe(CN)6]2+3K2C2O4;
本题答案为:3FeC2O4+2K3[Fe(CN)6]![]() Fe3[Fe(CN)6]2+3K2C2O4。
Fe3[Fe(CN)6]2+3K2C2O4。



