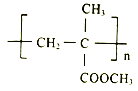题目内容
【题目】用海带制备单质碘,制备过程如下:
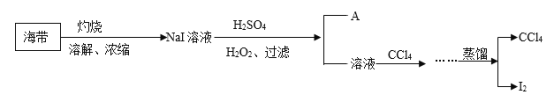
已知:常温下,碘在水中的溶解度为0.034g;碘的沸点为184℃;CCl4的沸点为77℃。
请回答:
(1)A物质是__________。
(2)写出在酸化下用H2O2氧化NaI的化学反应方程式_________________。
(3)流程中省略部分的操作是_____________。
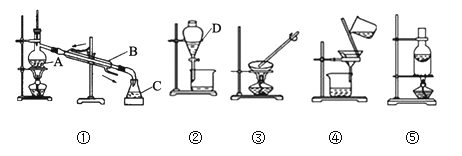
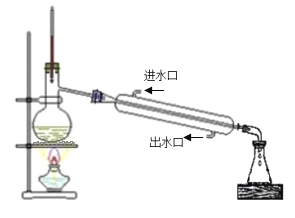
(4)蒸馏装置中错误的是__________________(写三条)。
(5)蒸馏出的CCl4液体中常会带淡紫色,可能的原因是______________
【答案】碘 2NaI+H2O2+H2SO4=I2+Na2SO4+2H2O 萃取、分液 温度计水银球位置不对;未加沸石;冷凝管水流方向不对;蒸馏装置密封 碘易升华
【解析】
(1)在酸性溶液中双氧水把碘化钠氧化为单质碘,反应中还有水和硫酸钠生成,由于常温下,碘在水中的溶解度为0.034g,因此过滤后得到的A物质是单质碘。
(2)在酸性溶液中双氧水把碘化钠氧化为单质碘,反应中还有水和硫酸钠生成,因此在酸化下用H2O2氧化NaI的化学反应方程式为2NaI+H2O2+H2SO4=I2+Na2SO4+2H2O。
(3)溶液中还有单质,碘易溶在有机溶剂四氯化碳中,则流程中省略部分的操作是萃取、分液。
(4)根据装置图可判断蒸馏装置中错误有:温度计水银球位置不对;未加沸石;冷凝管水流方向不对;蒸馏装置密封;
(5)由于碘易升华,因此蒸馏出的CCl4液体中常会带淡紫色。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目