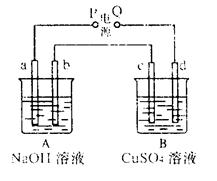
题目内容
(10)(1)氯碱工业是利用电解食盐水生产 ① 为基础的工业体系。
(2)电解前,为除去食盐水中的Mg2+、Ca2+、 等杂质离子,下列加入顺序合理的是 ②。
等杂质离子,下列加入顺序合理的是 ②。
(3)“盐泥”是粗盐提纯及电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
为生产七水硫酸镁,设计了以下工艺流程:

生产七水硫酸镁工艺流程图
1-反应器 2-过滤器 3-蒸发浓缩器 4-结晶槽 5-洗涤槽 6-真空干燥器
装置1中加入的酸应选用 ③ ,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4。其中碳酸钙可以转化为硫酸钙的原因是 ④ 。
装置2中滤渣的主要成分为 ⑤ 。
装置3中通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,此时析出的晶体主要是__⑥__。
用装置6(真空干燥器)干燥七水硫酸镁晶体的理由是 ⑦ 。
(2)电解前,为除去食盐水中的Mg2+、Ca2+、
 等杂质离子,下列加入顺序合理的是 ②。
等杂质离子,下列加入顺序合理的是 ②。| A.碳酸钠、氢氧化钠、氯化钡 | B.碳酸钠、氯化钡、氢氧化钠 |
| C.氢氧化钠、碳酸钠、氯化钡 | D.氯化钡、氢氧化钠、碳酸钠 |
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶于酸的物质 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |

生产七水硫酸镁工艺流程图
1-反应器 2-过滤器 3-蒸发浓缩器 4-结晶槽 5-洗涤槽 6-真空干燥器
装置1中加入的酸应选用 ③ ,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4。其中碳酸钙可以转化为硫酸钙的原因是 ④ 。
装置2中滤渣的主要成分为 ⑤ 。
装置3中通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,此时析出的晶体主要是__⑥__。
用装置6(真空干燥器)干燥七水硫酸镁晶体的理由是 ⑦ 。
(1)①氯气、烧碱、氢气(只写出氯气和烧碱也可)。(2分) (2)②D。
(3)③(稀)硫酸。 ④搅拌过程中CO2不断逸出,使平衡CaCO3+H2SO4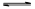 CaSO4+H2CO3(H2O+CO2↑)不断向右移动。(2分)
CaSO4+H2CO3(H2O+CO2↑)不断向右移动。(2分)
⑤CaSO4、BaSO4、其它不溶物质。(2分) ⑥氯化钠。 ⑦防止失去结晶水。
(3)③(稀)硫酸。 ④搅拌过程中CO2不断逸出,使平衡CaCO3+H2SO4
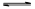 CaSO4+H2CO3(H2O+CO2↑)不断向右移动。(2分)
CaSO4+H2CO3(H2O+CO2↑)不断向右移动。(2分)⑤CaSO4、BaSO4、其它不溶物质。(2分) ⑥氯化钠。 ⑦防止失去结晶水。
(1)氯碱工业是利用电解食盐水生产氯气、烧碱、氢气为基础的工业体系。
(2)考查物质的分离和提纯。Ca2+用碳酸钠除去,Mg2+用氢氧化钡除去,SO42-用氯化钡除去,最后加入盐酸酸化。但用于过量的钡离子要用碳酸钠来除,所以碳酸钠必需放在氯化钡和氢氧化钡的后面,因此正确的答案选D。
(3)应用是生成七水硫酸镁,所以应该加入的是稀硫酸;应用在搅拌过程中CO2不断逸出,使平衡CaCO3+H2SO4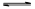 CaSO4+H2CO3(H2O+CO2↑)不断向右移动,所以碳酸钙可以转化为硫酸钙;根据“盐泥”的组成可知,装置2中的不溶物一定含有硫酸钡,同时还含有生成的硫酸钙等其它不溶物质;应用滤液中还含有氯化钠,所以通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,析出的晶体主要是氯化钠;应用在空气中加热硫酸镁晶体易失去结晶水,所以在真空中加热的目的就是防止失去结晶水。
CaSO4+H2CO3(H2O+CO2↑)不断向右移动,所以碳酸钙可以转化为硫酸钙;根据“盐泥”的组成可知,装置2中的不溶物一定含有硫酸钡,同时还含有生成的硫酸钙等其它不溶物质;应用滤液中还含有氯化钠,所以通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,析出的晶体主要是氯化钠;应用在空气中加热硫酸镁晶体易失去结晶水,所以在真空中加热的目的就是防止失去结晶水。
(2)考查物质的分离和提纯。Ca2+用碳酸钠除去,Mg2+用氢氧化钡除去,SO42-用氯化钡除去,最后加入盐酸酸化。但用于过量的钡离子要用碳酸钠来除,所以碳酸钠必需放在氯化钡和氢氧化钡的后面,因此正确的答案选D。
(3)应用是生成七水硫酸镁,所以应该加入的是稀硫酸;应用在搅拌过程中CO2不断逸出,使平衡CaCO3+H2SO4
 CaSO4+H2CO3(H2O+CO2↑)不断向右移动,所以碳酸钙可以转化为硫酸钙;根据“盐泥”的组成可知,装置2中的不溶物一定含有硫酸钡,同时还含有生成的硫酸钙等其它不溶物质;应用滤液中还含有氯化钠,所以通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,析出的晶体主要是氯化钠;应用在空气中加热硫酸镁晶体易失去结晶水,所以在真空中加热的目的就是防止失去结晶水。
CaSO4+H2CO3(H2O+CO2↑)不断向右移动,所以碳酸钙可以转化为硫酸钙;根据“盐泥”的组成可知,装置2中的不溶物一定含有硫酸钡,同时还含有生成的硫酸钙等其它不溶物质;应用滤液中还含有氯化钠,所以通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,析出的晶体主要是氯化钠;应用在空气中加热硫酸镁晶体易失去结晶水,所以在真空中加热的目的就是防止失去结晶水。
练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目