题目内容
【题目】(1)有关研究需要得到反应C3H8(g)===3C(石墨,s)+4H2(g)的ΔH,但测定实验难进行。设计下图可计算得到:

①ΔH______0(填“>”、“<”或“=”)。
②ΔH=____________________(用图中其他反应的反应热表示)。
(2)已知在压强为a MPa、500℃下,2 mol H2和1 mol CO2在某密闭容器中反应,生成水和气态二甲醚CH3OCH3 。其中CO2的转化率为60%,此过程中放出0.3Q kJ热量。此反应的热化学方程式为_____________。
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/(kJ·mol-1) | 198 | 360 | 498 | x |
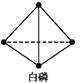
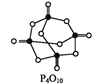
已知,白磷在空气中燃烧生成P4O10,白磷的燃烧热为2 982 kJ·mol-1,白磷(P4)、P4O10结构如图所示,则上表中x=____。
【答案】> ΔH1-ΔH2-ΔH3 2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH=-Q kJ·mol-1 585
CH3OCH3(g)+3H2O(g) ΔH=-Q kJ·mol-1 585
【解析】
①由图可知1molC3H8(g)、5molO2(g)的总能量低于3molC(石墨,s)、4molH2(g)和5molO2(g)的总能量,故C3H8(g)=3C(石墨,s)+4H2(g)为吸热反应,ΔH>0,故答案为:>。
②由图可写出下列热化学方程式:
①C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH1
②3C(石墨,s)+3O2(g)=3CO2(g) ΔH2
③4H2(g)+2O2(g)=4H2O(l) ΔH3
根据盖斯定律,由①-②-③可得:C3H8(g)=3C(石墨,s)+ 4H2(g) ΔH=ΔH1-ΔH2-ΔH3,故答案为:ΔH1-ΔH2-ΔH3。
(2)已知在aMPa、500℃下,2molH2和1molCO2在某密闭容器中反应,生成水和气态二甲醚CH3OCH3,其中CO2的转化率为60%,此过程中放出0.3QkJ热量,则当消耗2molCO2时,放出热量为QkJ,所以此反应的热化学方程式为:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH=-QkJ·mol-1,故答案为:2CO2(g)+6H2(g)
CH3OCH3(g)+3H2O(g) ΔH=-QkJ·mol-1,故答案为:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH=-QkJ·mol-1。
CH3OCH3(g)+3H2O(g) ΔH=-QkJ·mol-1。
(3)白磷燃烧的方程式为P4+5O2=P4O10,由二者的结构式可以看出:1mol白磷完全燃烧需拆开6molP-P键、5molO=O键,形成12molP-O键、4molP=O键,白磷的燃烧热为2982kJ·mol-1,所以共放出2982kJ热量,由于断裂化学键需要吸收能量,写出化学键需要放出能量,所以12mol×360kJ/mol+4mol×xkJ/mol-(6mol×198kJ/mol+5 mol×498kJ/mol)=2982kJ,解得x=585,故答案为:585。