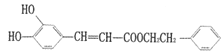
题目内容
【题目】有机物键线式结构的特点是以线示键,每个折点和线端点处表示有一个碳原子,并以氢补足四价,C、H不标示出来。降冰片烷的立体结构可用键线式表示为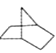
(1)其分子式为__________。
(2)当降冰片烷发生一氯取代时,能生成_________种沸点不同的产物。
(3)结合降冰片烷及其键线式,请你判断降冰片烷属于____________。
A.环烷烃 B.饱和烃 C.不饱和烃 D.芳香烃
(4)降冰片烷具有的性质是__________。
A.能溶于水 B.能发生加成反应
C.常温常压下为气体 D.能发生取代反应
【答案】 C7H12 3 AB D
【解析】(1)由结构简式可知分子式为为C7H12;
(2)由结构对称性可知,含3种位置的H,则一氯取代时,能生成3种沸点不同的产物;
(3)A.降冰片烷只存在碳碳单键且成环,故为环烷烃,故A正确;B.由于结构中无不饱和键,故为饱和烃,故B正确;C.由于结构中无不饱和键,故不属于不饱和烃,故C错误;D.此物质中不含苯环,故不是芳香烃,故D错误;故选AB。
(4)A.烃类均不溶于水,故A错误;B.结构中无不饱和键,故不能加成,故B错误;C.常温常压下,碳原子数小于等于4的烃类为气体,而降冰片烷碳原子数为7,则常温常压下不为气体,故C错误;D.由于为饱和烃,故能发生取代反应,故D正确;故选D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目