题目内容
【题目】硫代硫酸钠(Na2S2O3)又名大苏打、海波,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。实验室常以硫化钠(Na2S)为原料制取Na2S2O3。
实验项目I:工业级硫化钠的纯化。
本实验对Na2S的纯度要求较高,利用图1所示的装置将工业级的Na2S提纯。
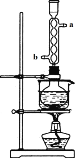
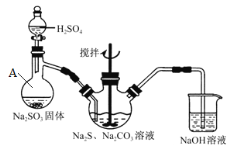
图1 图2
已知:Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。
提纯步骤依次为:
① 将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
② 按图1所示连接仪器,水浴加热;
冷凝管的作用是 。
向冷凝管中通入冷却水的方向是从 口进水(填“a”或“b”)。
③ 待烧瓶中固体不再减少时,停止加热,将烧瓶取下,趁热过滤,除去不溶物;
④ 将滤液转移至烧杯中,冷却结晶,过滤;
⑤ 将所得固体用少量 (填试剂名称)洗涤,干燥后得到Na2S·9H2O晶体。
实验项目II:硫代硫酸钠的制备。
制备步骤依次为:
① 称取一定质量的硫化钠晶体和碳酸钠固体,溶于水,转移至三颈瓶中;
② 按图2所示连接仪器,并在各仪器中加入相应的试剂,打开分液漏斗的活塞,使反应生成的气体较均匀地通入三颈瓶中,并用电磁搅拌器不断搅拌;
仪器A的名称为 。
写出三颈瓶中发生的反应的化学方程式: 。
③ 随着气体的通入,逐渐有浅黄色的硫析出,继续通入气体至溶液pH接近7,停止通入气体,取下三颈烧瓶,过滤;
实验过程中若未及时停止通入气体可能产生的后果为 。
④ 将滤液置于蒸发皿中加热,待 时,停止加热,冷却,过滤,即得Na2S2O3·5H2O晶体。
【答案】
②冷凝回流 b
⑤乙醇
②蒸馏烧瓶 Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2
③Na2S2O3在酸性环境中不稳定,产率降低
④少量晶体析出时
【解析】
试题分析:② 根据装置图可知冷凝管的作用是冷凝回流,为充分冷却,冷凝水应低进高出,从冷凝管的b进水;⑤硫化钠常温下微溶于酒精,所以用乙醇洗涤,防止硫化钠损失;②根据图示仪器A的名称为蒸馏烧瓶;写出三颈瓶中Na2CO3、2Na2S、4SO2发生反应生成Na2S2O3,化学方程式为Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2;③Na2S2O3在酸性环境中不稳定,实验过程中若未及时停止通入气体可能产生的后果为产率降低;④ 将滤液置于蒸发皿中加热,待少量晶体析出时时,停止加热,冷却,过滤,即得Na2S2O3·5H2O晶体。

【题目】下表是25℃时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是( )
化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
Ksp或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是
c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.碳酸钠溶液中滴加少量氯水的离子方程式H2O+2CO32-+Cl2=2HCO3-+Cl-+ClO-
C.向0.1mol/LCH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=9:5,此时溶液pH=5
D.向浓度均为1×10-3mol/L的KCl和K2CrO4混合液中滴加1×10-3mol/L的AgNO3溶液,CrO42-先形成沉淀