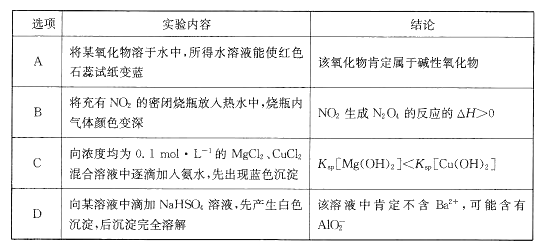
题目内容
【题目】元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分。
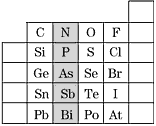
(1)上图中元素N在元素周期表中的位置为_________________,根据元素周期律,请预测H3AsO4、H3PO4的酸性强弱:H3AsO4________H3PO4(填“强于”或“弱于”)。
(2)上图中元素O、S、Se的氢化物的沸点由高到低为:________>________>________。(用化学式填写)_____________
(3)写出S2-的离子结构示意图为______________;判断表中Bi和Te两种元素的金属性强弱:Bi________Te(填“<”或“>”或“=”)。
(4)Br2具有较强的氧化性,SO2具有较强的还原性,请写出将SO2气体通入溴水中反应的离子方程式:________________________________。
【答案】第二周期第ⅤA族 弱于 H2O>H2Se>H2S 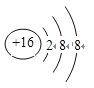 > Br2+SO2+2H2O=2Br-+SO42-+4H+
> Br2+SO2+2H2O=2Br-+SO42-+4H+
【解析】
(1)根据元素周期表中的排布规律:最外层电子数=族序数,电子层数等于周期数以及元素最高价氧化物对应水化物的酸性强弱来回答;
(2)元素O、S、Se的氢化物都是分子晶体,相对分子质量越大,沸点越高,注意水分子间形成氢键,故沸点变高。
(3)S2-的离子3个电子层,最外层8电子结构;同一周期中原子序数越大,金属性越弱,同一主族中,原子序数越大,非金属性越强,据此进行判断;
(4)将SO2气体通入溴水后,会发生氧化还原反应生成硫酸和氢溴酸,据此写出反应的离子方程式.
(1)阴影部分元素的最外层电子数均为5,最外层电子数=族序数,所以均是第ⅤA族的元素,氮元素的电子层数是2,所以氮是第二周期的元素,故氮元素位于第二周期第ⅤA族。同主族从上到下最高价氧化物对应水化物的酸性逐渐减弱,所以酸性:H3PO4>H2AsO4;
(2)元素O、S、Se的氢化物都是分子晶体,相对分子质量越大,沸点越高,注意水分子间形成氢键,故沸点变高。元素O、S、Se的氢化物的沸点由高到低为:H2O>H2Se>H2S。
(3)S2-的离子3个电子层,最外层8电子结构,S2-的离子结构示意图为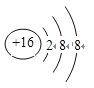 ;Bi与Po处于同一周期,原子序数:Bi<Po,则金属性:Bi>Po;Te与Po处于同一主族,原子序数:Te<Po,则金属性:Te<Po,所以Bi和Te的金属性大小为:Bi>Te;
;Bi与Po处于同一周期,原子序数:Bi<Po,则金属性:Bi>Po;Te与Po处于同一主族,原子序数:Te<Po,则金属性:Te<Po,所以Bi和Te的金属性大小为:Bi>Te;
(4)Br2具有较强的氧化性,SO2具有较强的还原性,二氧化硫与溴水反应生成硫酸和氢溴酸,反应的离子方程式为:SO2+Br2+2H2O=4H++SO42-+2Br-。

【题目】已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表所示:
电解质 | 醋酸 | 碳酸 | 亚硫酸 |
电离常数 | K=1.75×10-5 | K1=4.30×10-7 K2=5.61×10-11 | K1=1.00×10-2 K2=1.02×10-7 |
(1)写出亚硫酸的第一级电离平衡常数表达式:K1=_____________________。
(2)已知NaHSO3溶液显酸性,写出溶液中离子浓度大小_____________________。
(3)Na2CO3溶液去油污的原因: _____________________。(用化学用语表示)
(4)在相同条件下,试比较①CH3COONa ②NaHCO3 ③Na2SO3水溶液的碱性强弱:(填序号)_____________________。
(5)若保持温度不变,在醋酸溶液中加入少量醋酸钠,下列量会变小的是_________。(填序号)
A.c(CH3COO-) B.c(H+) C.醋酸电离平衡常数 D.醋酸的电离程度
(6)NaHSO3水解反应的平衡常数Kb=_______________ molL-1。
(7)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_________________________________。