题目内容
下列有关物质的性质或结构的说法正确的是( )A.
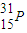 是一种广泛应用于含磷化合物的结构分析和医疗诊断的核素,其原子核内含有15个中子
是一种广泛应用于含磷化合物的结构分析和医疗诊断的核素,其原子核内含有15个中子B.Na的原子半径比Cl的大,但Na+的半径比Cl-的小
C.Li、Na、K、Rb、Cs都属于碱金属元素,它们单质的还原性随原子序数的增大而减弱
D.Cl与I同属于ⅦA族元素,则两者最高价氧化物对应水化物的酸性:HClO4<HIO4
【答案】分析:A、中子数=质量数-质子数,据此计算判断.
B、电子层相同,核电荷数越大原子半径越小,最外层电子数相同,电子层越多离子半径越大.
C、同主族自上而下,随电子层增多原子半径增大,原子核对核外电子的吸引减弱,金属性增强.
D、同主族自上而下,非金属性减弱,非金属性越强,最高价氧化物对应水化物的酸性越强.
解答:解:A、1531P的质子数为15,质量数为31,所以中子数为31-15=16,故A错误;
B、Na原子与Cl原子的电子层相同,Na的核电荷数较小,所以原子半径Na>Cl,Na+与Cl-的最外层电子数为8,Cl-电子层较多,所以离子半径Na+<Cl-,故B正确;
C、Li、Na、K、Rb、Cs的最外层电子数相同,电子层依次增大,原子核对核外电子的吸引减弱,金属性依次增强,单质的还原性随原子序数的增大而增强,故C错误;
D、同主族自上而下,非金属性减弱,非金属性Cl>I,非金属性越强,最高价氧化物对应水化物的酸性越强,所以酸性HClO4>HIO4,故D错误.
故选:B.
点评:考查半径比较、同主族元素的递变规律、原子构成等,难度不大,注意元素周期律的掌握与理解.
B、电子层相同,核电荷数越大原子半径越小,最外层电子数相同,电子层越多离子半径越大.
C、同主族自上而下,随电子层增多原子半径增大,原子核对核外电子的吸引减弱,金属性增强.
D、同主族自上而下,非金属性减弱,非金属性越强,最高价氧化物对应水化物的酸性越强.
解答:解:A、1531P的质子数为15,质量数为31,所以中子数为31-15=16,故A错误;
B、Na原子与Cl原子的电子层相同,Na的核电荷数较小,所以原子半径Na>Cl,Na+与Cl-的最外层电子数为8,Cl-电子层较多,所以离子半径Na+<Cl-,故B正确;
C、Li、Na、K、Rb、Cs的最外层电子数相同,电子层依次增大,原子核对核外电子的吸引减弱,金属性依次增强,单质的还原性随原子序数的增大而增强,故C错误;
D、同主族自上而下,非金属性减弱,非金属性Cl>I,非金属性越强,最高价氧化物对应水化物的酸性越强,所以酸性HClO4>HIO4,故D错误.
故选:B.
点评:考查半径比较、同主族元素的递变规律、原子构成等,难度不大,注意元素周期律的掌握与理解.

练习册系列答案
相关题目
下列有关物质的性质或应用说法不正确的是( )
| A、可用FeCl3溶液除去试管内壁上的难以刷去的铜迹 | B、浓硫酸能干燥氯气、一氧化碳等气体,说明浓硫酸具有吸水性 | C、二氧化硫具有漂白性,所以能使溴水和品红溶液褪色 | D、福尔马林、葡萄糖溶液与新制氢氧化铜悬浊液共热,都会有砖红色沉淀产生 |
下列有关物质的性质或应用的说法正确的是( )
| A、在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于侧链与苯环的相互影响,使侧链和苯环均易被氧化 | B、间二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构 | C、用核磁共振氢谱鉴别1-丙醇和2-丙醇 | D、甲烷、乙烯和苯在工业上都可通过石油分馏得到 |