题目内容
【化学–选修2:化学与技术】(15分)
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O),是重要的化工产品和强氧化剂。工业制备红矾钠的流程如下:

(1)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成 。
(2)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:4Fe(CrO2)2+8Na2CO3+7O2 = 2Fe2O3+8Na2CrO4+8CO2。为了加快该反应的反应速率,可采取的措施是 。(写一种即可)
(3)已知CrO42-在不同的酸性溶液中有不同的反应,如:
2CrO42-+2H+= Cr2O72-+H2O; 3CrO42-+4H+= Cr3O102-+2H2O
① 往混合溶液甲中加入硫酸必须适量的原因是 。
② 混合溶液乙中溶质的化学式是 。
(4)在含Cr2O72-废水中存在着平衡:Cr2O72-+H2O 2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
(5)请配平碱性溶液还原法中发生的离子反应:
□Cr2O72-+□S2-+□H2O ——□Cr(OH)3+□S2O32-+□OH-
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O),是重要的化工产品和强氧化剂。工业制备红矾钠的流程如下:

(1)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成 。
(2)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:4Fe(CrO2)2+8Na2CO3+7O2 = 2Fe2O3+8Na2CrO4+8CO2。为了加快该反应的反应速率,可采取的措施是 。(写一种即可)
(3)已知CrO42-在不同的酸性溶液中有不同的反应,如:
2CrO42-+2H+= Cr2O72-+H2O; 3CrO42-+4H+= Cr3O102-+2H2O
① 往混合溶液甲中加入硫酸必须适量的原因是 。
② 混合溶液乙中溶质的化学式是 。
(4)在含Cr2O72-废水中存在着平衡:Cr2O72-+H2O
 2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。(5)请配平碱性溶液还原法中发生的离子反应:
□Cr2O72-+□S2-+□H2O ——□Cr(OH)3+□S2O32-+□OH-
(15分)(1)FeO·Cr2O3(2分)
(2)粉碎矿石、升高温度(2分)
(3)① 少量不能除尽Na2CO3等杂质,过量会生成Na2Cr3O10等副产物。(2分)
② Na2Cr2O7和Na2SO4(2分)
(4)c(CrO42-)2c(H+)2/c(Cr2O72-) (2分) 正向(2分)
(5) 4 6 19 8 3 14 (3分)
(2)粉碎矿石、升高温度(2分)
(3)① 少量不能除尽Na2CO3等杂质,过量会生成Na2Cr3O10等副产物。(2分)
② Na2Cr2O7和Na2SO4(2分)
(4)c(CrO42-)2c(H+)2/c(Cr2O72-) (2分) 正向(2分)
(5) 4 6 19 8 3 14 (3分)
试题分析:(1)根据元素的化合价,把盐写成氧化物的形式,中间用·连接,Fe(CrO2)2中Fe为+2价,对应氧化物为FeO,Cr为+3价,对应氧化物为Cr2O3,所以Fe(CrO2)2的氧化物形式为FeO·Cr2O3;
(2)考虑综合效益,加快反应速率,可以升高温度或把矿石粉碎;
(3)① 加硫酸的目的是除去杂质碳酸钠,少量不能除尽Na2CO3等杂质,过量会生成Na2Cr3O10等副产物,所以加入硫酸必须适量;
②因为最终得到的晶体是Na2Cr2O7·2H2O,所以混合溶液乙中的溶质是Na2Cr2O7及Na2SO4;
(4)根据化学平衡常数的表达式,Cr2O72-+H2O
 2CrO42-+2H+平衡常数K=c(CrO42-)2c(H+)2/c(Cr2O72-) ;加水稀释,反应物、生成物的浓度均减小,但生成物的浓度幂之积减小的更多,平衡正向移动;
2CrO42-+2H+平衡常数K=c(CrO42-)2c(H+)2/c(Cr2O72-) ;加水稀释,反应物、生成物的浓度均减小,但生成物的浓度幂之积减小的更多,平衡正向移动;(5)根据得失电子守恒法配平方程式,Cr2O72-中Cr为+6价,产物Cr(OH)3中Cr为+3价;反应物中S元素的化合价为-2价,产物中S元素的化合价为+2价,Cr2O72-中Cr整体降6价,S整体升高8价,6、8的最小公倍数是24,所以6×4,Cr2O72-前的系数是4,Cr(OH)3前的系数是8;8×3,所以S2O32-前的系数是3,S2-前的系数是6,根据电荷守恒配平OH-的系数是14,观察法配平H2O的系数是19,所以答案是 4 6 19 8 3 14 。

练习册系列答案
相关题目
 2H++Cl-+C1O-
2H++Cl-+C1O- 2Cu+O2
2Cu+O2 +4H+
+4H+ K2S+N2↑+3CO2↑
K2S+N2↑+3CO2↑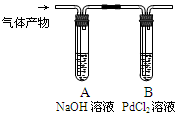
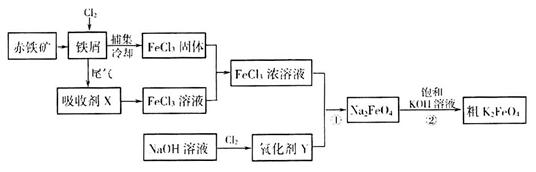
 2Fe(s)+3CO(g)△H=+489.0KJ·mol
2Fe(s)+3CO(g)△H=+489.0KJ·mol ;
;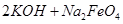 =
= ,说明此温度下
,说明此温度下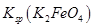 __________
__________ 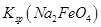 (填“>”或“<”)。
(填“>”或“<”)。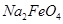 完全转化为
完全转化为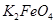 ,若最终制得粗产品
,若最终制得粗产品 3Zn(OH)2+2Fe(OH)3+4KOH,放电时电池的负极反应式为______________________________________。
3Zn(OH)2+2Fe(OH)3+4KOH,放电时电池的负极反应式为______________________________________。 NH3↑+H2O
NH3↑+H2O HSO3-十OH—
HSO3-十OH—