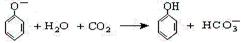题目内容
(17分)铁及其化合物在日常生活、生产中应用广泛。氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
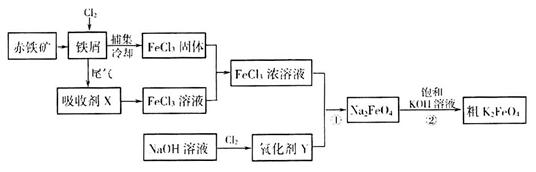
请回答下列问题
(1)已知:①Fe2O3(s)+3C(石墨) 2Fe(s)+3CO(g)△H=+489.0KJ·mol
2Fe(s)+3CO(g)△H=+489.0KJ·mol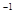 ;
;
②C(石墨)+CO2(g) 2CO(g)△H=+172.5KJ·mol
2CO(g)△H=+172.5KJ·mol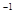 ;用赤铁矿为原料在高炉炼铁过程中发生的主要反应为Fe2O3(s)+3CO(g)
;用赤铁矿为原料在高炉炼铁过程中发生的主要反应为Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)△H= KJ·mol
2Fe(s)+3CO2(g)△H= KJ·mol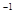 。
。
(2)吸收剂x的溶质为____________(写化学式)。
(3)氧化剂Y为“84消毒液”的有效成分,则在碱性条件下反应①的离子方程式为
__________________________________________________________________
(4)过程②是在某低温下进行的,反应的化学方程式为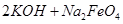 =
=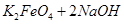 ,说明此温度下
,说明此温度下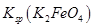 __________
__________ 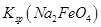 (填“>”或“<”)。
(填“>”或“<”)。
假定此过程中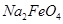 完全转化为
完全转化为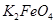 ,若最终制得粗产品
,若最终制得粗产品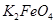 206.25t,产品纯度为96%,则理论上至少需要氧化剂Y的质量是___________t。
206.25t,产品纯度为96%,则理论上至少需要氧化剂Y的质量是___________t。
(5)高铁电池是一种新型二次电池,电解液为强碱溶液,其电池反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,放电时电池的负极反应式为______________________________________。
3Zn(OH)2+2Fe(OH)3+4KOH,放电时电池的负极反应式为______________________________________。

请回答下列问题
(1)已知:①Fe2O3(s)+3C(石墨)
 2Fe(s)+3CO(g)△H=+489.0KJ·mol
2Fe(s)+3CO(g)△H=+489.0KJ·mol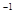 ;
;②C(石墨)+CO2(g)
 2CO(g)△H=+172.5KJ·mol
2CO(g)△H=+172.5KJ·mol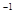 ;用赤铁矿为原料在高炉炼铁过程中发生的主要反应为Fe2O3(s)+3CO(g)
;用赤铁矿为原料在高炉炼铁过程中发生的主要反应为Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)△H= KJ·mol
2Fe(s)+3CO2(g)△H= KJ·mol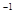 。
。(2)吸收剂x的溶质为____________(写化学式)。
(3)氧化剂Y为“84消毒液”的有效成分,则在碱性条件下反应①的离子方程式为
__________________________________________________________________
(4)过程②是在某低温下进行的,反应的化学方程式为
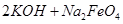 =
=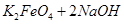 ,说明此温度下
,说明此温度下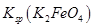 __________
__________ 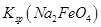 (填“>”或“<”)。
(填“>”或“<”)。假定此过程中
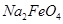 完全转化为
完全转化为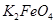 ,若最终制得粗产品
,若最终制得粗产品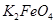 206.25t,产品纯度为96%,则理论上至少需要氧化剂Y的质量是___________t。
206.25t,产品纯度为96%,则理论上至少需要氧化剂Y的质量是___________t。(5)高铁电池是一种新型二次电池,电解液为强碱溶液,其电池反应为:3Zn+2K2FeO4+8H2O
 3Zn(OH)2+2Fe(OH)3+4KOH,放电时电池的负极反应式为______________________________________。
3Zn(OH)2+2Fe(OH)3+4KOH,放电时电池的负极反应式为______________________________________。(1)-28.5 (3分) (2)FeCl2(3分)
(3)2Fe3++3ClO-+10OH-="=" 2FeO42-+3Cl-+5H2O(3分)
(4)< (2分) 111.75(3分)
(5)Zn+2OH--2e-="=" Zn(OH)2(3分)
(3)2Fe3++3ClO-+10OH-="=" 2FeO42-+3Cl-+5H2O(3分)
(4)< (2分) 111.75(3分)
(5)Zn+2OH--2e-="=" Zn(OH)2(3分)
试题分析:(1)已知:①Fe2O3(s)+3C(石墨)
 2Fe(s)+3CO(g)△H=+489.0KJ·mol—1;
2Fe(s)+3CO(g)△H=+489.0KJ·mol—1;②C(石墨)+CO2(g)
 2CO(g)△H=+172.5KJ·mol—1;根据盖斯定律:①—②×3得
2CO(g)△H=+172.5KJ·mol—1;根据盖斯定律:①—②×3得Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g)△H=-28.5KJ·mol—1。(2)根据题给流程知,尾气氯气与吸收剂x反应生成氯化铁溶液,则吸收剂x的溶质为FeCl2。(3)根据题给流程知,“84消毒液”的有效成分次氯酸钠在碱性条件下与三氯化铁溶液反应生成高铁酸钠,利用化合价升降法结合原子守恒、电荷守恒知,该反应的离子方程式为2Fe3++3ClO-+10OH-="=" 2FeO42-+3Cl-+5H2O;(4)由题给反应知,高铁酸钠在在某低温下转化为高铁酸钾,根据沉淀转化知识知,沉淀易向更难溶的方向转化,,说明此温度下Ksp(K2FeO4)<Ksp(K2FeO4)。由题给反应得关系式:3NaClO——2K2FeO4,将题给数据代入关系式计算得需要氧化剂NaClO的质量是111.75t。(5)由题给电池反应知,该电池放电时,负极上锌失电子和氢氧根离子反应生成氢氧化锌,电极反应式为:Zn+2OH--2e-=Zn(OH)2。
2Fe(s)+3CO2(g)△H=-28.5KJ·mol—1。(2)根据题给流程知,尾气氯气与吸收剂x反应生成氯化铁溶液,则吸收剂x的溶质为FeCl2。(3)根据题给流程知,“84消毒液”的有效成分次氯酸钠在碱性条件下与三氯化铁溶液反应生成高铁酸钠,利用化合价升降法结合原子守恒、电荷守恒知,该反应的离子方程式为2Fe3++3ClO-+10OH-="=" 2FeO42-+3Cl-+5H2O;(4)由题给反应知,高铁酸钠在在某低温下转化为高铁酸钾,根据沉淀转化知识知,沉淀易向更难溶的方向转化,,说明此温度下Ksp(K2FeO4)<Ksp(K2FeO4)。由题给反应得关系式:3NaClO——2K2FeO4,将题给数据代入关系式计算得需要氧化剂NaClO的质量是111.75t。(5)由题给电池反应知,该电池放电时,负极上锌失电子和氢氧根离子反应生成氢氧化锌,电极反应式为:Zn+2OH--2e-=Zn(OH)2。
练习册系列答案
相关题目

 2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。 CH3COO- + NH4+ +3NH3 + 2Ag↓+2H+
CH3COO- + NH4+ +3NH3 + 2Ag↓+2H+