题目内容
【题目】将一定质量的铜片加入到20 mL某浓度的浓硝酸中,充分反应后,铜片全部溶解,并收集到标准状况下的混合气体共896mL(假设气体中只有NO和NO2)。向反应后所得溶液中逐滴滴加1mol/L的NaOH溶液,产生沉淀质量与加入Na0H溶液体积(单位:mL)的关系如图所示。回答下列问题:
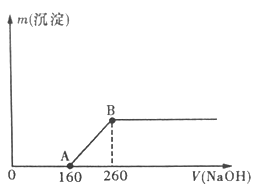
(1)B点所表示溶液中只含一种溶质,该物质是_______(填化学式)。
(2)收集的气体中,NO2的物质的量为______mol。
(3)铜片的质量为______g。
(4)原浓硝酸的浓度为________________mol/L。
【答案】 NaNO3 0.01 3.2 15
【解析】开始加入氢氧化钠溶液时无沉淀生成,说明Cu与硝酸反应时硝酸过量,A点是剩余的硝酸与氢氧化钠溶液反应生成硝酸钠溶液和Cu与HNO3 反应生成的Cu(NO3)2 的混合液,B点是Cu(NO3)2 与氢氧化钠溶液恰好生成沉淀的最大点,B点的溶质全是NaNO3 。
(1)根据上述可知:B点Cu2+完全沉淀,溶液中只有Na+和NO3-,故溶质只有NaNO3。
(2)混合气体共896m,物质的量为0.04mol。设NO的物质的量为x,NO2 的物质的量为y,则有x+y=0.04;又根据从A点到B点,Cu2+ 消耗了100ml的氢氧化钠溶液可知Cu 的物质的量为0.1*1/2=0.05mol。根据得失电子守恒还有3x+y=0.05*2,y=0.01mol。所以NO2 的物质的量为0.01mol。
(3)根据从A点到B点,Cu2+ 消耗了100ml的氢氧化钠溶液可知Cu 的物质的量为0.1*1/2=0.05mol,所以铜的质量为0.05*64g=3.2g。
(4)HNO3在反应中一部分转化为NO、NO2,另一部分转化为硝酸钠,根据原子守恒有:HNO3 的物质的量等于生成的气体NO2、NO的物质的量和NaNO3的物质的量之和,n=0.04+0.26*2=0.3mol,所以硝酸的浓度为0.3/0.02=15(mol/L)

 阅读快车系列答案
阅读快车系列答案