题目内容
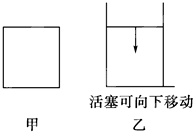 在甲、乙(如图所示)两个容积相同的容器中进行如下反应:3A(g)+B(g)?2C(g).若保持温度相同,分别向两个容器中通入3mol A和1mol B,则达到平衡时两容器中C的体积分数的大小关系为( )
在甲、乙(如图所示)两个容积相同的容器中进行如下反应:3A(g)+B(g)?2C(g).若保持温度相同,分别向两个容器中通入3mol A和1mol B,则达到平衡时两容器中C的体积分数的大小关系为( )| A、甲>乙 | B、甲<乙 | C、甲=乙 | D、无法确定 |
分析:甲为恒温恒容容器,乙为恒温恒压容器,若保持温度相同,分别向两个容器中通入3mol A和1mol B,甲中反应达到平衡气体物质的量减小,乙容器中反应达到平衡,为保持恒压,反应过程中压强大于甲容器,所以最后达到平衡后,C的体积分数大于甲容器中C的体积分数;
解答:解:甲为恒温恒容容器反应达到平衡,乙为恒温恒压容器,达到平衡过程中需要保持压强不变,若保持温度相同,分别向两个容器中通入3mol A和1mol B,甲中反应达到平衡气体物质的量减小,乙容器中反应达到平衡,为保持恒压,反应过程中压强大于甲容器,所以最后达到平衡后,C的体积分数大于甲容器中C的体积分数,即甲<乙;
故选:B.
故选:B.
点评:本题考查了恒温恒容、恒温恒压容器中的反应达到平衡的过程分析判断,掌握容器的特征和条件分子是解题关键,题目难度中等.

练习册系列答案
相关题目
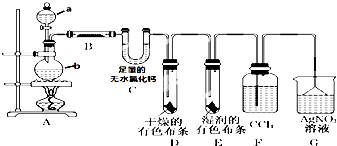 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.(1)①分别写出a、b的实验仪器名称
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.(1)①分别写出a、b的实验仪器名称

