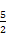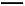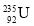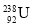题目内容
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)已知在25 ℃、101 kPa时,C(s)、H2(g)和CO(g)燃烧的热化学方程式分别为:
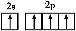
C(s)+O2(g) CO2(g) ΔH1=-393.5 kJ/mol;
CO2(g) ΔH1=-393.5 kJ/mol;
H2(g)+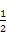 O2(g)
O2(g)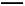 H2O(g) ΔH2=-241.8 kJ/mol;
H2O(g) ΔH2=-241.8 kJ/mol;
CO(g)+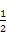 O2(g)
O2(g)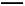 CO2(g) ΔH3=-283.0 kJ/mol;
CO2(g) ΔH3=-283.0 kJ/mol;
①则C(s)+H2O(g) CO(g)+H2(g) ΔH= ,该反应平衡常数的表达式为K= ;升高温度,则K值 (填“变大”、“变小”或“不变”)。
CO(g)+H2(g) ΔH= ,该反应平衡常数的表达式为K= ;升高温度,则K值 (填“变大”、“变小”或“不变”)。
②如果①反应在容积不变的密闭容器中进行,当反应达到平衡时 (填编号)。
a.v正(CO)∶v逆(H2)=1∶1
b.碳的质量保持不变
c.v正(CO)=v逆(H2O)
d.容器中的压强不变
③在容积不变的密闭容器中进行①反应,可以使c(CO)增大的是 。
a.升高温度
b.充入He(g),使体系压强增大
c.将H2(g)从体系中分离出来
d.加入催化剂
(2)将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下2组数据:
CO2(g)+H2(g),得到如下2组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
①实验1中以v(CO2)表示的反应速率为 。
②向实验2的平衡混合物中再加入0.4 mol H2O(g)和0.4 mol CO2,达到新平衡时CO的转化率 (填“变大”、“变小”或“不变”)。
(1)①+131.3 kJ/mol 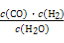 变大
变大
②abcd ③ac
(2)①0.16 mol/(L·min) ②变小
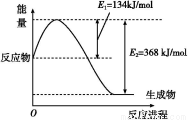
【解析】(1)①根据盖斯定律,可得ΔH=+131.3 kJ/mol,为吸热反应,升高温度,平衡正向移动,平衡常数变大;②a项,生成CO的速率等于生成H2的速率又等于消耗H2的速率,正确;b项,碳的质量保持不变,则气体的量不变,正确;c项,CO的生成速率等于H2O的消耗速率又等于H2O的生成速率,正确;d项,该反应气体计量数之和前后不同,则压强不变,能说明反应达到平衡,正确;③升高温度,平衡正向移动,c(CO)增大,a正确;充入He(g),压强增大,但平衡不移动,c(CO)不变,b错误;将H2(g)从体系中分离出来,平衡正向移动,c(CO)增大,c正确;催化剂不改变平衡状态,d错误。
(2)①可以先求出v(CO)=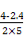 mol/(L·min)=0.16 mol/(L·min),根据反应速率之比等于计量数之比,
mol/(L·min)=0.16 mol/(L·min),根据反应速率之比等于计量数之比,
则v(CO2)=0.16 mol/(L·min);
②根据三段式计算,求得平衡状态各物质的物质的量,
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始量mol:2100
转化量mol:0.40.40.40.4
平衡量mol:1.60.60.40.4
容器体积为2 L,则K=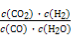 =
=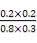 =
= ,再加入0.4 mol H2O(g)和0.4 mol CO2,Qc=
,再加入0.4 mol H2O(g)和0.4 mol CO2,Qc=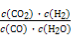 =
=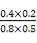 =
=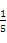 >
> ,根据化学平衡常数只与温度有关,即K不变,则平衡逆向移动,故CO转化率变小。
,根据化学平衡常数只与温度有关,即K不变,则平衡逆向移动,故CO转化率变小。

 字词句段篇系列答案
字词句段篇系列答案阿司匹林(乙酰水杨酸,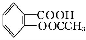 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
乙酸酐+水杨酸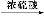
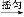
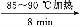
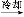
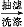 粗产品
粗产品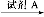
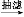
 乙酰水杨酸
乙酰水杨酸
(阿司匹林) 测熔点
测熔点
主要试剂和产品的物理常数
名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
水杨酸 | 138 | 158(熔点) | 微溶 |
醋酸酐 | 102 | 139.4(沸点) | 反应 |
乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是 。
(2)①合成阿司匹林时,最合适的加热方法是 。
②加热后冷却,未发现被冷却容器中有晶体析出,此时应采取的措施是 。
③抽滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是 。
(3)试剂A是 。
另一种改进的提纯方法如下:
粗产品
 乙酰水杨酸
乙酰水杨酸
(4)改进的提纯方法中加热回流的装置如图所示,
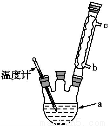
①使用温度计的目的是 。
②此种提纯方法中乙酸乙酯的作用是: ,所得产品的有机杂质要比原方案少,原因是 。
今有室温下四种溶液,有关叙述不正确的是( )
| ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH:①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(N )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
D.Va L ④与Vb L ②溶液混合,若混合后溶液pH=4,则Va∶Vb=11∶9