题目内容
(8分)德国人哈伯在1913年实现了合成氨的工业化生产,反应原理:
N2(g)+3H2(g) 2NH3(g);已知298 K时,
2NH3(g);已知298 K时,
ΔH=-92.4 kJ·mol-1,ΔS=-198.2 J·mol-1·K-1,试回答下列问题:
(1)计算说明298 K下合成氨反应能否自发进行?________(填“能”或“不能”);在298 K时,将10 mol N2和30 mol H2放入合成塔中,为什么放出的热量小于924 kJ?________。
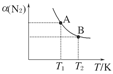
(2)如图在一定条件下,将1 mol N2和3 mol H2混合于一个10 L的密闭容器中,反应达到A平衡时,混合气体中氨占25%,试回答下列问题:
①N2的转化率为________;
②在达到状态A时,平衡常数KA=________(代入数值的表达式,不要求得具体数值),当温度由T1变化到T2时,KA________KB(填“=”、“<”或“>”)。
③在达到状态B时,下列说法正确的是( )
a.通入氩气使压强增大,化学平衡向正反应方向移动
b.N2的正反应速率是H2的逆反应速率的1/3倍
c.降低温度,混合气体的平均相对分子质量变小
d.增加N2的物质的量,H2的转化率降低
(3)若在恒温、恒压条件下合成氨反应达到平衡后,再向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”)。
(4)在1998年希腊亚里斯多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温高压下高转化率的电化学合成氨,其实验装置如图:
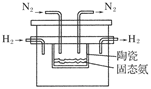
则阴极的电极反应式为____________________________________________________。
N2(g)+3H2(g)
 2NH3(g);已知298 K时,
2NH3(g);已知298 K时,ΔH=-92.4 kJ·mol-1,ΔS=-198.2 J·mol-1·K-1,试回答下列问题:
(1)计算说明298 K下合成氨反应能否自发进行?________(填“能”或“不能”);在298 K时,将10 mol N2和30 mol H2放入合成塔中,为什么放出的热量小于924 kJ?________。

(2)如图在一定条件下,将1 mol N2和3 mol H2混合于一个10 L的密闭容器中,反应达到A平衡时,混合气体中氨占25%,试回答下列问题:
①N2的转化率为________;
②在达到状态A时,平衡常数KA=________(代入数值的表达式,不要求得具体数值),当温度由T1变化到T2时,KA________KB(填“=”、“<”或“>”)。
③在达到状态B时,下列说法正确的是( )
a.通入氩气使压强增大,化学平衡向正反应方向移动
b.N2的正反应速率是H2的逆反应速率的1/3倍
c.降低温度,混合气体的平均相对分子质量变小
d.增加N2的物质的量,H2的转化率降低
(3)若在恒温、恒压条件下合成氨反应达到平衡后,再向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”)。
(4)在1998年希腊亚里斯多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温高压下高转化率的电化学合成氨,其实验装置如图:

则阴极的电极反应式为____________________________________________________。
(1)能'由于合成氨反应为可逆反应,10 mol N2和30 mol H2不可能完全反应,所以放出的热量小于10×92.4 kJ=924 kJ
(2)①40%'②0.082/(0.06×O.183)'>'③b
(3)向左'(4)N2+6e-+6H+===2NH3
(2)①40%'②0.082/(0.06×O.183)'>'③b
(3)向左'(4)N2+6e-+6H+===2NH3
(1)ΔH-TΔS=-92.4 kJ·mol-1-298 K×(-198.2 J·mol-1·K-1)×10-3 kJ·J-1=-33.3 kJ·moL-1<0,故该反应在298 K时能自发进行。由于合成氨反应为可逆反应,10 mol N2和30 mol H2不可能完全反应,所以放出的热量小于10×92.4 kJ=924 kJ。
(2)由反应:设转化了N2为x mol·L-1,
则 N2(g)+3H2(g) 2NH3(g)
2NH3(g)
初始: 0.1 0.3 0
转化: x 3x 2x
平衡: 0.1-x 0.3-3x 2x
2x/(0.1-x+0.3-3x+2x)×100%=25%'x=0.04
所以①N2的转化率为:0.04/0.1×100%=40%。
②平衡常数KA=0.082/(0.06×0.183)。当温度由T1变化到T2时,N2的转化率降低,说明化学平衡向逆反应方向移动,所以KA>KB。③由于在恒容密闭容器中通入氩气,体系压强确实增大,但由于N2、H2、NH3的浓度均不发生变化,化学平衡不移动,故a错误;达到平衡时正、逆反应速率相等,即v(N2,正)=v(N2,逆)、v(H2,正)=v(H2,逆),由“化学反应速率之比等于化学方程式中化学计量数之比”知b正确;降低温度,化学平衡向正反应方向移动,气体物质的量减少,而气体总质量不变,根据M=m/n知,混合气体的平均相对分子质量增大,故c错误;增加N2的物质的量,化学平衡向正反应方向移动,H2的转化率升高,故d错误。
(3)在恒压条件下加入氩气,则容积增大,导致原平衡中各物质的浓度同等比例减小,所以平衡向气体体积增大的方向即向左移动。
(4)由于该反应的总式为合成氨反应:N2+3H2 2NH3,在该反应中,H2失去电子在阳极上发生氧化反应,其电极反应式为:3H2-6e-===6H+,则阴极电极反应式为“该反应的总式减去阳极电极反应式”得:N2+6e-+6H+===2NH3。
2NH3,在该反应中,H2失去电子在阳极上发生氧化反应,其电极反应式为:3H2-6e-===6H+,则阴极电极反应式为“该反应的总式减去阳极电极反应式”得:N2+6e-+6H+===2NH3。
(2)由反应:设转化了N2为x mol·L-1,
则 N2(g)+3H2(g)
 2NH3(g)
2NH3(g)初始: 0.1 0.3 0
转化: x 3x 2x
平衡: 0.1-x 0.3-3x 2x
2x/(0.1-x+0.3-3x+2x)×100%=25%'x=0.04
所以①N2的转化率为:0.04/0.1×100%=40%。
②平衡常数KA=0.082/(0.06×0.183)。当温度由T1变化到T2时,N2的转化率降低,说明化学平衡向逆反应方向移动,所以KA>KB。③由于在恒容密闭容器中通入氩气,体系压强确实增大,但由于N2、H2、NH3的浓度均不发生变化,化学平衡不移动,故a错误;达到平衡时正、逆反应速率相等,即v(N2,正)=v(N2,逆)、v(H2,正)=v(H2,逆),由“化学反应速率之比等于化学方程式中化学计量数之比”知b正确;降低温度,化学平衡向正反应方向移动,气体物质的量减少,而气体总质量不变,根据M=m/n知,混合气体的平均相对分子质量增大,故c错误;增加N2的物质的量,化学平衡向正反应方向移动,H2的转化率升高,故d错误。
(3)在恒压条件下加入氩气,则容积增大,导致原平衡中各物质的浓度同等比例减小,所以平衡向气体体积增大的方向即向左移动。
(4)由于该反应的总式为合成氨反应:N2+3H2
 2NH3,在该反应中,H2失去电子在阳极上发生氧化反应,其电极反应式为:3H2-6e-===6H+,则阴极电极反应式为“该反应的总式减去阳极电极反应式”得:N2+6e-+6H+===2NH3。
2NH3,在该反应中,H2失去电子在阳极上发生氧化反应,其电极反应式为:3H2-6e-===6H+,则阴极电极反应式为“该反应的总式减去阳极电极反应式”得:N2+6e-+6H+===2NH3。
练习册系列答案
相关题目

