题目内容
【题目】某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL容量瓶中配制250 mL烧碱溶液
B.用移液管(或碱式滴定管)量取25.00 mL烧碱溶液于锥形瓶中并加几滴甲基橙指示剂
C.在天平上准确称取烧碱样品w g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为m mol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度V1 mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL 请完成下列问题:
(1)正确的操作步骤是(填写字母) _____________________________________.
(2)滴定管读数应注意_________________________________________________.
(3)操作中锥形瓶下垫一张白纸的作用是______________________________________.
(4)操作D中液面应调整到________________________;尖嘴部分应____________.
(5)滴定到终点时锥形瓶内溶液的pH约为___________;终点时的颜色变化是________.
(6)若酸式滴定管没用标准H2SO4润洗,会对测定结果有何影响________,若酸式滴定管终点读数俯视,对测定结果有何影响__________(填“偏高”、“偏低”或“无影响”,其他操作均正确).
(7)该烧碱样品的纯度计算式是_______________________________________.
【答案】 C A BD E 滴定管垂直 装液和放液后需要等一会,等液面上下不发生变化时才能读数;读数时要平视,视线与凹液面最低点相平;读数应到0.01 mL 便于准确判断滴定终点时溶液的颜色变化情况 零刻度或零刻度以下的某一刻度 充满溶液,无气泡 3.1~4.4 由黄色变为橙色 偏高 偏低 ![]() %
%
【解析】(1)实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,然后用标准液进行滴定,故答案为:CABDE;
(2)滴定管读数时滴定管须垂直,装液和放液后需要等一会,等液面上下不发生变化时才能读数;读数时要平视,视线与凹液面最低点相平;读数应到0.01 mL,故答案为:滴定管垂直;装液和放液后需要等一会,等液面上下不发生变化时才能读数;读数时要平视,视线与凹液面最低点相平;读数应到0.01 mL;
(3)操作中锥形瓶下垫一张白纸,可以使滴定终点颜色变化更明显,便于分辨,故答案为:便于准确判断滴定终点时溶液的颜色变化情况;
(4)滴定管0刻度在上,滴定前应调节到零刻度或零稍下的某一刻度,为减小误差,尖嘴部分应充满液体,无气泡,故答案为:零刻度或零刻度以下的某一刻度;充满溶液,无气泡;
(5)指示剂为甲基橙,变色范围为3.1-4.4,终点时pH约为4左右,溶液由黄色变为橙色,且半分钟内不恢复为原来的颜色;故答案为:4左右(或3.1-4.4);溶液由黄色变为橙色;
(6)若酸式滴定管没用标准H2SO4润洗,会导致标准液的浓度偏小,滴定过程中消耗的标准液的体积偏大,根据c(待测)= 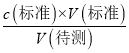 ,c(待测)偏高;若酸式滴定管终点读数俯视,会导致读数偏小,使得标准液的体积偏小,根据c(待测)=
,c(待测)偏高;若酸式滴定管终点读数俯视,会导致读数偏小,使得标准液的体积偏小,根据c(待测)= 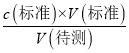 ,c(待测)偏低,故答案为:偏高;偏低;
,c(待测)偏低,故答案为:偏高;偏低;
(7)滴到消耗的硫酸为:n(硫酸)=cV=(V2-V1)×10-3L×m mol/L,根据反应方程可知,n(NaOH)=2n(硫酸)=2m(V2-V1)×10-3mol,所以原来样品中氢氧化钠的物质的量为:2m(V2-V1)×10-3mol×![]() =2m(V2-V1)×10-2mol,则样品中氢氧化钠的质量为m(NaOH)=nM=80m(V2-V1)×10-2g,则该烧碱样品的纯度为:
=2m(V2-V1)×10-2mol,则样品中氢氧化钠的质量为m(NaOH)=nM=80m(V2-V1)×10-2g,则该烧碱样品的纯度为: ![]() ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为: ![]() ×100%。
×100%。




