题目内容
已知反应4NH3+5O2 4NO+6H2O,若在反应开始后5s~10s之间的反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列判断正确的关系是( )。
4NO+6H2O,若在反应开始后5s~10s之间的反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列判断正确的关系是( )。
A.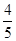 v(NH3)=v(O2) v(NH3)=v(O2) | B.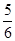 v(O2)=v(H2O) v(O2)=v(H2O) |
C.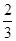 v(NH3)=v(H2O) v(NH3)=v(H2O) | D.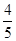 v(O2)=v(NO) v(O2)=v(NO) |
D
解析试题分析:根据反应速率之比是相应的化学计量数之比可知,v(H2O)= v(NH3)=
v(NH3)= v(NO)= v(O2),所以选项D正确,答案选D。
v(NO)= v(O2),所以选项D正确,答案选D。
考点:考查化学反应速率的有关计算

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2molA和1molB,发生反应如下:2A(g)+B(g) 2D(g) △H=-QKJ·mol-1。相关条件和数据见下表:
2D(g) △H=-QKJ·mol-1。相关条件和数据见下表:
| 实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
| 反应温度/℃ | 800 | 800 | 850 |
| 达平衡时间/min | 40 | 10 | 30 |
| c(D)平衡/mol·L-1 | 0.5 | 0.5 | 0.15 |
| 反应的能量变化/KJ | Q1 | Q2 | Q3 |
A.可用压强或密度是否发生变化判断上述反应是否达到平衡
B.实验Ⅱ可能隐含的条件是使用催化剂,实验Ⅲ达平衡时υ(D)为0.01mol·L-1·min-1
C.由表中信息可知Q>O,并显有Q3<Q2=Q1=Q
D.实验Ⅰ达平衡后,恒温下再向容器中通入1molA和1molD,达平衡时c(D)为1.0mol·L-1。
在密闭容器中进行下列反应:M(气)+N(气) R(气)+2L此反应符合下面图象,下列叙述正确的是( )
R(气)+2L此反应符合下面图象,下列叙述正确的是( )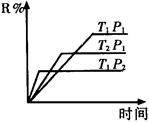
| A.正反应吸热,L是气体 |
| B.正反应吸热,L是固体 |
| C.正反应放热,L是气体 |
| D.正反应放热,L是固体或液体 |
下列各选项中所述的两个量,前者一定大于后者的是
| A.1 L 0.3 mol·L-1 CH3COOH溶液和3 L 0.1 mol·L-1 CH3COOH溶液中的H+数 |
| B.纯水在25℃和80℃时的pH |
| C.在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数 |
| D.相同条件下,H2分别与Cl2、F2反应的反应速率 |
下列有关反应限度的说法错误的是
| A.某条件下可逆反应达到限度之前,逆反应速率逐渐增大可能与生成物浓度逐渐增大有关 |
| B.炼铁高炉尾气中CO含量不随高炉高度改变而改变,是因为有关反应达到了限度 |
| C.化学反应的限度决定了反应物在该条件下的最大转化率 |
| D.可逆反应的限度不随反应条件的改变而改变 |
可逆反应H2(g)+I2(g)  2HI(g)在密闭容器中反应,达到平衡状态时的标志是( )
2HI(g)在密闭容器中反应,达到平衡状态时的标志是( )
| A.混合气体的密度不再改变 | B.混合气体的颜色不再改变 |
| C.混合气体的压强不再改变 | D.I2、H2在混合气体中的体积分数相等 |
在一恒容的密闭容器中充入0.1 mol/L CO2、0.1 mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)  2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是
2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是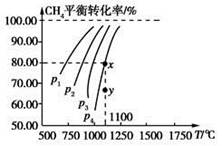
| A.上述反应的ΔH<0 |
| B.压强:p4>p3>p2>p1 |
| C.1100 ℃时该反应平衡常数为1.64 |
| D.压强为p4时,在y点:v正>v逆 |
已知(HF)2(g)  2HF(g) ΔH>0,且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
2HF(g) ΔH>0,且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是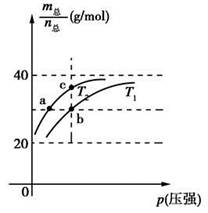
| A.温度:T1<T2 |
| B.平衡常数:K(a)=K(b)<K(c) |
| C.反应速率:vb>va |
D.当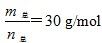 时,n(HF):n[(HF)2]=2:1 时,n(HF):n[(HF)2]=2:1 |