题目内容
下列各选项中所述的两个量,前者一定大于后者的是
| A.1 L 0.3 mol·L-1 CH3COOH溶液和3 L 0.1 mol·L-1 CH3COOH溶液中的H+数 |
| B.纯水在25℃和80℃时的pH |
| C.在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数 |
| D.相同条件下,H2分别与Cl2、F2反应的反应速率 |
B
解析试题分析:A.两种溶质的物质的量相同。在相同的温度下,浓度越大,电离程度就越小,因此后者电离产生的H+数比前者大。错误。B.水是弱电解质。电解质的电离过程是吸热过程,水解升高温度促进水的电离。因此纯水在80℃时比25℃电离产生的c(H+)大。c(H+)越大,溶液的pH就越小。故纯水在25℃和80℃时的pH前者大于后者。正确。C. 该反应方程式为4NH3+6NO=5N2+6H2O.在该反应中被氧化的N原子是4个,被还原的N原子的个数6个,后者多于前者。错误。D.由于非金属性F>Cl,元素的非金属性越强,其单质与氢气化合越容易,因此相同条件下,H2分别与Cl2、F2反应的反应速率后者大于前者。错误。
考点:考查弱电解质的电离、氧化还原反应及化学反应速率的比较的知识。

密闭容器中,发生反应:CO(g) + 2H2(g) CH3OH(g) △H<0,下列说法正确的是
CH3OH(g) △H<0,下列说法正确的是
| A.一定温度下,压缩容器体积,则正反应速率加快,逆反应速率减慢 |
| B.若v生成(CH3OH)=v消耗(CO),则该反应达到平衡状态 |
C.升高温度,重新达到平衡时,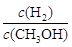 增大 增大 |
| D.使用催化剂,反应的平衡常数增大 |
一定温度下,对于反应N2+O2 2NO在密闭容器中进行,下列措施能增大反应速率的是 ( )。
2NO在密闭容器中进行,下列措施能增大反应速率的是 ( )。
| A.降低温度 | B.恒容充入氮气 | C.恒压充入氦气 | D.恒容充入氦气 |
(9分)在2 L密闭容器内,800℃时反应2SO2(g)+O2(g) 2SO3(g)体系中,n(SO2)随时间的变化如下表:
2SO3(g)体系中,n(SO2)随时间的变化如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)(mol) | 0.020 | 0. 010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图所示,表示SO3变化曲线的是_____,用O2表示从0 s~2 s内该反应的平均速率:v=__;
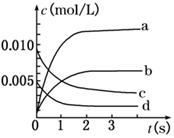
(3)能说明该反应已达到平衡状态的是________。
a.v(SO3)=2v(O2) b.混合气体中SO2的体积分数保持不变
c.v逆(SO2)=2v正(O2) d.容器内密度保持不变
下列措施对增大反应速率明显有效地是 ( )
| A.Na与水反应时增大水的用量 |
| B.Fe与稀硫酸反应制取氢气时,改用浓硫酸 |
| C.在K2SO4与BaCl2两溶液反应时,增大压强 |
| D.将铝片改为铝粉,做铝与氧气反应的实验 |
为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位学生分别设计了如下A~D四个实验,你认为得出的结论不正确的是 ( )
| A.在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快 |
| B.将相同大小、形状的镁条和铝条分别与相同浓度的盐酸反应时,两者速率一样大 |
| C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解 |
| D.两支试管中分别加入相同浓度相同体积的双氧水,其中一支试管中再加入几滴氯化铁溶液,产生氧气的快慢不同 |
已知反应4NH3+5O2 4NO+6H2O,若在反应开始后5s~10s之间的反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列判断正确的关系是( )。
4NO+6H2O,若在反应开始后5s~10s之间的反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列判断正确的关系是( )。
A. v(NH3)=v(O2) v(NH3)=v(O2) | B.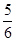 v(O2)=v(H2O) v(O2)=v(H2O) |
C.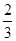 v(NH3)=v(H2O) v(NH3)=v(H2O) | D. v(O2)=v(NO) v(O2)=v(NO) |
COCl2俗名称作光气,是有毒气体。在一定条件下,可发生的化学反应为: COCl2(g) CO(g)+Cl2(g) ΔH<0下列有关说法不正确的是
CO(g)+Cl2(g) ΔH<0下列有关说法不正确的是
| A.在一定条件下,使用催化剂能加快反应速率 |
| B.当反应达平衡时,恒温恒压条件下通入Ar,COCl2的转化率不变 |
| C.单位时间内生成CO和消耗Cl2的物质的量比为1∶1时,反应达到平衡状态 |
| D.平衡时,其他条件不变,升高温度可使该反应的平衡常数减小 |
决定化学反应速率的主要因素是
| A.参加反应的物质本身的性质 | B.催化剂 |
| C.温度、压强以及反应物的接触面 | D.反应物的浓度 |