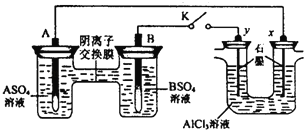
��Ŀ����
����Ŀ��Ϊ̽����CO2������ȼ�ϼ״��ķ�Ӧԭ�����ֽ�������ʵ�飺�����Ϊ1 L���ܱ������У�����1 mol CO2��3 molH2��һ�������·�����Ӧ��
CO2(g)��3H2(g) ![]() CH3OH(g)��H2O(g) ��H����49.0 kJ��mol��1
CH3OH(g)��H2O(g) ��H����49.0 kJ��mol��1
T�¶��£����CO2��CH3OH(g)��Ũ����ʱ��仯����ͼ����ش��������⣺

�� ��ƽ��ʱ��������ƽ��Ũ��ΪC (H2)�� ��
�� �ܹ�˵���÷�Ӧ�Ѵﵽƽ����� (����ĸ��ţ���ͬ)��
A�����¡�����ʱ�������ڵ�ѹǿ���ٱ仯
B�����¡�����ʱ�������ڻ��������ܶȲ��ٱ仯
C��һ�������£�CO��H2��CH3OH��Ũ�ȱ��ֲ���
D��һ�������£���λʱ��������3 mol H2��ͬʱ����1 mol CH3OH
�� ���д�ʩ����ʹƽ��������![]() �������______________��
�������______________��
A��������� B������He(g)��ʹ��ϵѹǿ����
C����H2O(g)����ϵ�з��� D�������¶�
�� ����¶�(T)�¸÷�Ӧ��ƽ�ⳣ��K �� ������ʼʱ���1 L�ܱ������г���1 mol CO2��2molH2��1.5mol CH3OH��1 mol H2O(g)����Ӧ�� ����������������������Ӧ������С�
���𰸡���1���� 0.75mol/L�� �� AC���� CD�� �� 5.33��![]() ������
������
��������
�����������1�����ﵽƽ��ʱ����c(CH3OH)=0.75mol��L��1��������c(H2)=0.75��3mol��L��1=2.25mol����ƽ��ʱc(H2)=(3/1��2.25)mol/L=0.75mol/L����A����Ӧǰ������ϵ��֮�Ͳ���ȣ����ѹǿ���䣬˵����Ӧ�ﵽƽ�⣬����ȷ��B�������ܶȵĶ��壬�����������䣬����״̬��������䣬����ܶȲ��䣬����˵����Ӧ�ﵽƽ�⣬�ʴ���C�����ݻ�ѧƽ��״̬�Ķ��壬����ֵ�Ũ�Ȳ��ٸı䣬˵����Ӧ�ﵽƽ�⣬����ȷ��D���ò�ͬ���ʵķ�Ӧ���ʣ��жϴﵽƽ�⣬Ҫ��Ӧ����һ��һ�棬�������������ɼ״�����Ӧ����������Ӧ������У��ʴ���ʹ�ô�������ѧƽ�ⲻ�ƶ����˱�ֵ���䣬�ʴ���B������He������Ǻ���״̬����ֵ�Ũ�Ȳ��䣬ƽ�ⲻ�ƶ�����ֵ���䣬�ʴ���C������ϵ�з���H2O(g)�������������Ũ�ȣ�ƽ�����ƣ��״��������ӣ���˱�ֵ������ȷ��D���˷�Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�����ƣ��״�����CO2���٣���ֵ������ȷ���ܸ��ݻ�ѧƽ�ⳣ���Ķ��壬K=0.75��0.75/(0.25��0.753)=16/3����ʱŨ����Ϊ1��1.5/(1��23)=0.1875<16/3��˵��ƽ��������Ӧ�����ƶ���