题目内容
在一定温度下,10L密闭容器中加入5.0molSO2、4.5molO2,发生反应:2SO2 + O2 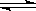 2SO3经10min后反应达平衡时O2的浓度为0.30mol/L。请计算(写出计算过程):
2SO3经10min后反应达平衡时O2的浓度为0.30mol/L。请计算(写出计算过程):
(1)10min内SO2的转化率;
(2)平衡常数K。
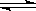 2SO3经10min后反应达平衡时O2的浓度为0.30mol/L。请计算(写出计算过程):
2SO3经10min后反应达平衡时O2的浓度为0.30mol/L。请计算(写出计算过程):(1)10min内SO2的转化率;
(2)平衡常数K。
(1)60% (2)7.5L/mol
试题分析:10L密闭容器在10min内各物质浓度发生的变化如下:
2SO2 + O2
 2SO3
2SO3起始浓度(mol/L)0.50 0.45 0
变化浓度(mol/L)0.30 0.15 0.30
平衡浓度(mol/L)0.20 0.30 0.30
则:(1)10min内SO2的转化率为:
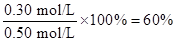
(2)平衡常数

点评:对于化学平衡的相关计算,应利用“三段式法”,可以起到事半功倍的效果。另外应掌握化学平衡常数只与温度有关,温度不变,平衡常数的值不变。

练习册系列答案
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案
相关题目
 N2O4(g) 达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数( )
N2O4(g) 达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数( ) N2O4(g) 达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数 ( )
N2O4(g) 达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数 ( ) 2HI(g) ②C(s)+H2O(g)
2HI(g) ②C(s)+H2O(g) nW(g);ΔH ,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
nW(g);ΔH ,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
 2 NH3的说法不正确的是( )
2 NH3的说法不正确的是( ) 4C (g) △H >0 达到平衡时,c(A) ="2" mol·L-1,c ( B) =" 7" mol·L-1,c ( C) =" 4" mol·L-1。试确定B的起始浓度c (B)的取值范围是 ;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是 。
4C (g) △H >0 达到平衡时,c(A) ="2" mol·L-1,c ( B) =" 7" mol·L-1,c ( C) =" 4" mol·L-1。试确定B的起始浓度c (B)的取值范围是 ;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是 。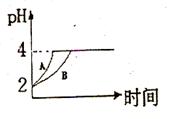
 bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断( )
bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断( )