题目内容
某溶液含有K+、Cu2+、Fe3+、Al3+、Fe2+、Cl—、CO2—3、OH—、NO—3、SO2—4中的几种,已知该溶液中各离子物质的量浓度均为0.2mol/L(不考虑水的电离及离子的水解)。为确定该溶液中含有的离子,现进行了如下的操作:
I.取少量溶液,加入KSCN溶液时无明显变化:
Ⅱ.取原溶液加入BaCl2溶液,有白色沉淀生成;
Ⅲ.另取溶液加入盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类没有增加。
请推断:
(l)仅由操作I及现象可得出的结论是____。
(2)仅由操作Ⅱ及现象可得出的结论是____。
(3)由操作Ⅲ及现象可得出溶液中一定含有的阳离子是____(写离子符号)。操作Ⅲ中发生反应的化学方程式为____。
(4)结合三步操作及题干已知,你认为原溶液中所含离子种类共有____种。
(5)另取l00mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为 g,写出此过程中涉及氧化还原反应的化学方程式____。
I.取少量溶液,加入KSCN溶液时无明显变化:
Ⅱ.取原溶液加入BaCl2溶液,有白色沉淀生成;
Ⅲ.另取溶液加入盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类没有增加。
请推断:
(l)仅由操作I及现象可得出的结论是____。
(2)仅由操作Ⅱ及现象可得出的结论是____。
(3)由操作Ⅲ及现象可得出溶液中一定含有的阳离子是____(写离子符号)。操作Ⅲ中发生反应的化学方程式为____。
(4)结合三步操作及题干已知,你认为原溶液中所含离子种类共有____种。
(5)另取l00mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为 g,写出此过程中涉及氧化还原反应的化学方程式____。
(1) 溶液中一定不含有Fe3+(2分)
(2) 溶液中可能含有CO32-或SO42-,或者说同时含有CO32-和SO42- (2分)
(3) Fe2+(1分) 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O(2分) 2NO+O2=2NO2 (2分)
(4) 5种(2分)
(5) 3.2g(2分) 4Fe(OH)2+O2+2H2O=4Fe(OH)3 (2分)
(2) 溶液中可能含有CO32-或SO42-,或者说同时含有CO32-和SO42- (2分)
(3) Fe2+(1分) 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O(2分) 2NO+O2=2NO2 (2分)
(4) 5种(2分)
(5) 3.2g(2分) 4Fe(OH)2+O2+2H2O=4Fe(OH)3 (2分)
试题分析:第Ⅰ步中,证明没有Fe3+;第Ⅱ步中表明溶液中可能含有CO32-或SO42-,或者说同时含有CO32-和SO42-;第 Ⅲ中,加入盐酸后,溶液中阴离子种类没有增加,证明没有CO32,但一定含有Cl—,若不含有Cl—则加入盐酸后会增加阴离子的种类。也一定含有NO3—、Fe2+不然的话,也不可能产生在空气中能变成红棕色的无色气体。因此溶液中含有的阴离子一定为:NO3—、SO42-、Cl—;阳离子含有Fe2+,除此之外,根椐溶液呈电中性的原理,再加上溶液中每种离子都为0.2mol/L,表明原溶液中还含有一种离子,这种离子只能是Cu2+。所以总共为五种离子。
依据原子守恒的原理,可知另取l00mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体为的0.02molCuO和0.01mol Fe2O3,所以总质量为3.2g。

练习册系列答案
相关题目
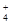 ,Na+,HSO
,Na+,HSO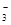 ,PO
,PO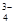 ,MnO
,MnO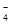
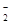 ,NO
,NO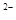 ,SO
,SO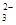
 ,CO
,CO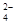 ,Cl
,Cl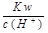 ="0.1" mol/L的溶液中:Na+,K+,SO
="0.1" mol/L的溶液中:Na+,K+,SO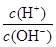 =1×1014的溶液:Ba2+、Na+、SO32-、NO3-
=1×1014的溶液:Ba2+、Na+、SO32-、NO3-