题目内容
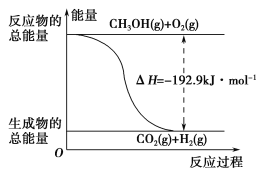
【题目】以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备 Fe(OH)2,装置如图所示,其中电解池两极材料分别为铁和石墨,通电一段时间后,右侧玻璃管中产生大量的白色沉淀。则下列说法正确的是( )

A. 石墨电极Ⅱ处的电极反应式为O2+4e-===2O2-
B. X是铁电极
C. 电解池中有1mol Fe溶解,石墨Ⅰ耗H2 22.4 L
D. 若将电池两极所通气体互换,X、Y两极材料也要互换。
【答案】D
【解析】
A.通入氧气的电极II是正极,电极反应式为O2+4e-+2CO2=2CO32-,故A错误;
B.X是阴极、Y是阳极,阴极反应式为2H2O+2e-=H2↑+2OH-,故X是石墨电极,故B错误;
C.电解池中阳极电极反应为Fe-2e-![]() Fe2+,若有 1mol Fe溶解,依据电子转移守恒,在石墨Ⅰ耗1molH2,在标准状况下是22.4L,题中未注明标准状况,故C错误;
Fe2+,若有 1mol Fe溶解,依据电子转移守恒,在石墨Ⅰ耗1molH2,在标准状况下是22.4L,题中未注明标准状况,故C错误;
D.若将电池两极所通气体互换,X、Y两极材料也互换,则Y极产物的氢气能起保护气作用,防止X极产生的氢氧化铁迅速氧化,实验方案更合理,故D正确;
本题答案为D。

练习册系列答案
相关题目