题目内容
3.图中方框内区域表示所有的化学反应,大圈内区域表示氧化还原反应,大圈外区域表示非氧化还原反应,其中A~D分别表示四种基本反应类型.请分别填出:
(1)若图中B圈表示化合反应,则C圈表示分解反应(填反应所属的基本类型)
加热
(2)属于区域3的化学反应是D
A.Cl2+2KBr═Br2+2KCl
B.2NaHCO3═Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O$\frac{\underline{\;加热\;}}{\;}$4Fe(OH)3
D.CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O.
分析 (1)置换反应一定属于氧化还原反应,复分解反应一定不属于氧化还原反应,有单质生成的分解反应属于氧化还原反应,有单质参加的化合反应属于氧化还原反应;
(2)区域3表示的是:属于氧化还原反应,但不属于化合反应、分解反应或置换反应.
解答 解:(1)置换反应一定属于氧化还原反应,复分解反应一定不属于氧化还原反应,有单质生成的分解反应属于氧化还原反应,有单质参加的化合反应属于氧化还原反应,所以化合反应和分解反应与氧化还原反应属于交叉关系,置换反应被氧化还原反应包含,复分解反应和氧化还原反应既不交叉也不被包含,若B表示化合反应,则C表示分解反应,A表示置换反应,D表示复分解反应.
故答案为:分解;
(2)A.Cl2+2KBr═Br2+2KCl,属于氧化还原反应,但也属于置换反应,故A不选;
B.2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+H2O+CO2↑,不属于氧化还原反应,故B不选;
C.4Fe(OH)2+O2+2H2O═4Fe(OH)3,属于氧化还原反应,但也属于化合反应,故C不选;
D.CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O,属于氧化还原反应,但不属于化合反应、分解反应或置换反应,故D选.
故答案为:D.
点评 本题考查基本反应类型与氧化还原反应反应的关系及氧化还原反应的配平,难度不大.明确包含与交叉的意义即可解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.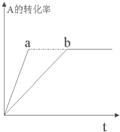 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)(放热反应),图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)(放热反应),图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是( )
 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)(放热反应),图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)(放热反应),图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是( )| A. | 增大A的浓度 | B. | 扩大容器的容积 | C. | 加入催化剂 | D. | 升高温度 |
8.由铜、锌、CuSO4溶液,ZnSO4溶液组成如图所示的原电池,则下列说法正确是( )


| A. | a极为铜,b极为锌 | |
| B. | 当正极质量增加64g时,负极质量减小65g | |
| C. | A池中盛放的是CuSO4溶液,B池中盛放的是ZnSO4溶液 | |
| D. | 盐桥中的阳离子向锌极移动,阴离子向铜极移动 |
15.分液漏斗在使用前,必须进行的操作是( )
| A. | 打开活塞 | B. | 拔下玻璃塞 | C. | 检查是否漏水 | D. | 检查是否干燥 |
12.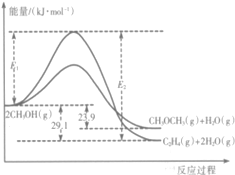 醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
i.2CH3OH(g)?CH3OCH3(g)+H2O(g)
ii.2CH3OH(g)?C2H4(g)+2H2O(g)
I.上述反应过程中能量变化如图所示:
(1)在某密闭容器中,充人一定量CH3OH(g)发生上述两个反应,反应i(填“i”或“ii”)的速率较大,其原因为该反应的活化能较小.若在容器中加入催化剂,使ii的反应速率增大,则E1和E2-E1的变化是:E1减小;E2-E1不变(填“增大”、“减小”或“不变”).
(2)已知:CH3CH2OH(g)=CH3OCH3(g)△H=+50.7kJ/mol.则乙烯气相直接水合反应C2H4(g)+H2O(g)═C2H5OH(g)的△H=-45.5kJ•mol-1.
Ⅱ,某研究小组通过控制反应条件,在三个容积均为2L的密闭容器中只发生反应i,起始反应温度均为T℃,起始投料如下表所示:
(3)比较平衡时容器1中c1(H2O)和容器2中c2(H2O)的大小:c1(H2O)<c2(H2O)(填“>”、“<”或“=”);三个容器中反应的化学平衡常数分别记为K1、K2和K3,三者的大小关系为K1=K2>K3.
(4)若容器l中平衡时CH3OH(g) 的转化率为80%,则该温度下反应i的平衡常数K=4.
 醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:i.2CH3OH(g)?CH3OCH3(g)+H2O(g)
ii.2CH3OH(g)?C2H4(g)+2H2O(g)
I.上述反应过程中能量变化如图所示:
(1)在某密闭容器中,充人一定量CH3OH(g)发生上述两个反应,反应i(填“i”或“ii”)的速率较大,其原因为该反应的活化能较小.若在容器中加入催化剂,使ii的反应速率增大,则E1和E2-E1的变化是:E1减小;E2-E1不变(填“增大”、“减小”或“不变”).
(2)已知:CH3CH2OH(g)=CH3OCH3(g)△H=+50.7kJ/mol.则乙烯气相直接水合反应C2H4(g)+H2O(g)═C2H5OH(g)的△H=-45.5kJ•mol-1.
Ⅱ,某研究小组通过控制反应条件,在三个容积均为2L的密闭容器中只发生反应i,起始反应温度均为T℃,起始投料如下表所示:
| 编号 起始投料/mol | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 恒温容器1 | 2 | 0 | 0 |
| 恒温容器2 | 0 | 2 | 2 |
| 绝热容器3 | 2 | 0 | 0 |
(4)若容器l中平衡时CH3OH(g) 的转化率为80%,则该温度下反应i的平衡常数K=4.
 如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
如图所示,U形管内盛有100mL的溶液,按要求回答下列问题: -CH=CHCOOCH2CH2-
-CH=CHCOOCH2CH2-
 CH=CH2+2ROH+2CO+O2CH3
CH=CH2+2ROH+2CO+O2CH3  CH=CHCOOR+2H2O
CH=CHCOOR+2H2O 或
或 (写1种);由Ⅳ生成Ⅱ的反应条件为NaOH醇溶液,加热.
(写1种);由Ⅳ生成Ⅱ的反应条件为NaOH醇溶液,加热.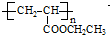 可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3.
可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3.