题目内容
下列实验能达到目的的是



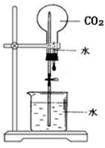




| A.除去乙烷中混有的乙烯 | B.石油蒸馏 | C.乙醇催化氧化 | D.CO2喷泉实验 |
C
试题分析:A.除去乙烷中混有的乙烯,不能使用酸性高锰酸钾溶液,酸性高锰酸钾溶液氧化乙烯生成二氧化碳碳气体,引入新的杂质,故错误;B.石油蒸馏时,温度计的水银球应在支管口处,故错误;D.CO2喷泉实验,不能使用水,因为二氧化碳是可溶于水,在水中溶解度不大,不能形成喷泉,故错误。

练习册系列答案
相关题目

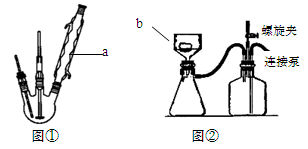
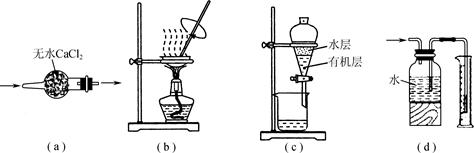

 、SO
、SO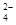 离子的实验方法正确的是________(填编号)。
离子的实验方法正确的是________(填编号)。