题目内容
已二酸是一种重要的化工中间体,可通过氧化环已醇得到。
反应原理为:

实验步骤:
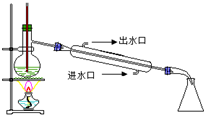
步骤1.在图①所示装置的三颈瓶中加入6gKMnO4和50mL0.3mol/LNaOH溶液,搅拌加热使之溶解。
步骤2.在继续搅拌下用滴管滴加21mL环已醇,控制滴加速度,维持反应温度43~47℃。滴加完毕后,在沸水浴中将混合物加热几分钟。
步骤3.用图②所示装置趁热抽滤,二氧化锰滤渣用水洗2~3次
步骤4.滤液用小火加热蒸发浓缩至原来体积的一半,冷却后再用浓盐酸酸化至pH为2~4,冷却析出粗产品
步骤5.将粗产品用水进行重结晶提纯,然后在烘箱中烘干。
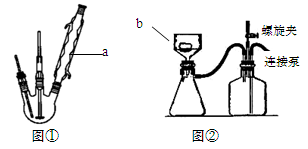
(1)写出实验仪器名称:a ; b 。
(2)步骤2在沸水浴中将混合物加热几分钟的目的是: 。
(3)步骤3趁热抽滤的目的是: ;如何证明步骤3滤渣已洗涤干净: 。
(4)步骤4用盐酸酸化的目的是: 。
(5)确定最后产品成分为已二酸,还需做的实验或仪器分析有 。
反应原理为:

实验步骤:
步骤1.在图①所示装置的三颈瓶中加入6gKMnO4和50mL0.3mol/LNaOH溶液,搅拌加热使之溶解。
步骤2.在继续搅拌下用滴管滴加21mL环已醇,控制滴加速度,维持反应温度43~47℃。滴加完毕后,在沸水浴中将混合物加热几分钟。
步骤3.用图②所示装置趁热抽滤,二氧化锰滤渣用水洗2~3次
步骤4.滤液用小火加热蒸发浓缩至原来体积的一半,冷却后再用浓盐酸酸化至pH为2~4,冷却析出粗产品
步骤5.将粗产品用水进行重结晶提纯,然后在烘箱中烘干。

(1)写出实验仪器名称:a ; b 。
(2)步骤2在沸水浴中将混合物加热几分钟的目的是: 。
(3)步骤3趁热抽滤的目的是: ;如何证明步骤3滤渣已洗涤干净: 。
(4)步骤4用盐酸酸化的目的是: 。
(5)确定最后产品成分为已二酸,还需做的实验或仪器分析有 。
(1)球形冷凝管(1分);布氏漏斗(1分)。
(2)使生成的二氧化锰凝聚成大颗粒(2分)。
(3)减少已二酸盐的析出(2分);
取最后一次洗涤滤液,滴入酚酞,溶液不变红说明已洗涤干净(2分)。
(4)将已二酸盐转变为已二酸(2分)。 (5)测定产品的熔点和红外光谱等(2分)。
(2)使生成的二氧化锰凝聚成大颗粒(2分)。
(3)减少已二酸盐的析出(2分);
取最后一次洗涤滤液,滴入酚酞,溶液不变红说明已洗涤干净(2分)。
(4)将已二酸盐转变为已二酸(2分)。 (5)测定产品的熔点和红外光谱等(2分)。
试题分析:⑴根据装置图可知a为球形冷凝管,b为布氏漏斗;
⑵为了使生成的二氧化锰凝聚成大颗粒,应该在沸水浴中将混合物加热几分钟;
⑶在步骤3中通过趁热抽滤能减少已二酸盐的析出;取步骤3中的最后一次洗涤滤液,滴入酚酞,溶液不变红(无NaOH)说明已洗涤干净;
⑷在步骤4中用盐酸酸化,能将已二酸盐转变为已二酸(产品);
⑸通过测定产品的熔点和红外光谱等能确定产品成分是否为已二酸。

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目