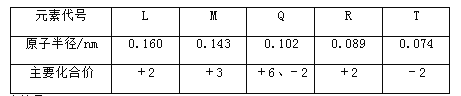
题目内容
【题目】N2H4通常用作火箭的高能燃料,N2O4作氧化剂。请回答下列问题:
(1)已知:N2(g)+2O2(g)=2NO2(g) ΔH=+a kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-b kJ/mol
2NO2(g)N2O4(g) ΔH=-c kJ/mol
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式__________________。
(2) N2、H2合成氨气为放热反应。800 K时向下列起始体积相同的密闭容器中充入2molN2、3molH2,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙是绝热容器,三容器各自建立化学平衡。
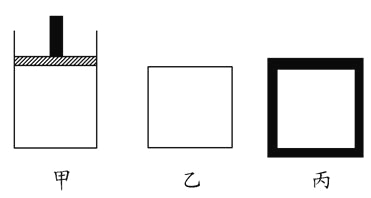
①达到平衡时,平衡常数K甲__________K乙__________K丙(填“>”、“<”或“=”)。
②达到平衡时N2的浓度c(N2)甲__________c(N2)乙,c(N2)乙__________c(N2)丙(填“>”、“<”或“=”)。
③对甲、乙、丙三容器的描述,以下说法正确的是__________。
A.乙容器气体密度不再变化时,说明此反应已达到平衡状态
B.在甲中充入稀有气体He,化学反应速率加快
C.向甲容器中充入氨气,正向速率减小,逆向速率增大
D.丙容器温度不再变化时说明已达平衡状态
【答案】
(1)2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)ΔH=-(a-c+2b)kJ/mol
(2)①=>②> <③CD
【解析】
试题分析:(1)①N2(g)+2O2(g)=2NO2(g) ΔH=+a kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-b kJ/mol
③2NO2(g)N2O4(g) ΔH=-c kJ/mol
依据盖斯定律②-(①+③)得到2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-(a-c+2b)kJ/mol。
(2)①甲乙容器温度不变,平衡常数不变,丙容器绝热,温度升高平衡逆向进行,平衡常数减小,故K甲=K乙>K丙。
②甲容器在反应过程中保持压强不变,故容器体积减小,氮气的浓度增大;乙容器保持体积不变,随着反应的进行,压强减小;丙容器绝热,温度升高平衡逆向进行,故达到平衡时N2的浓度c(N2)甲>c(N2)乙<c(N2)丙。
③A.密度=m/V,总质量一定,乙容器为恒容装置,密度一直不变,则当气体密度不再变化时,不能说明此反应已达到平衡状态,故A错误;B.甲为恒压装置,在甲中充入稀有气体He,总体积增大,反应物浓度减小,化学反应速率减小,故B错误;C.向甲容器中充入氨气,正向速率减小,逆向速率增大,故C正确;D.丙容器绝热,故丙容器温度不再变化时说明已达平衡状态,故D正确; 故答案为CD。