题目内容
把Ca(OH)2放入蒸馏水中,一段时间后达到如下平衡:

 ,下列说法正确的是( )
,下列说法正确的是( )
| A.恒温下向溶液中加CaO,溶液的pH升高 |
| B.给溶液加热,溶液的pH升高 |
| C.向溶液中加入Na2CO3溶液,其中固体质量增加 |
| D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变 |
C
解析试题分析:A、恒温下向溶液中加入CaO,CaO与水反应生成氢氧化钙,溶液中有氢氧化钙沉淀生成,溶液仍为饱和溶液,氢氧化钙的浓度不变,pH不变,错误;B、Ca(OH)2的溶解度随温度的升高而降低,给溶液加热,有氢氧化钙沉淀析出,氢氧化钙的浓度减小,溶液pH减小,错误;C、向溶液中加入Na2CO3溶液,发生Ca2++CO32-=CaCO3↓,其中固体质量增加,正确;D、向溶液中加入少量NaOH固体,溶液中氢氧根浓度增大,平衡逆向移动,Ca(OH)2固体质量增加,错误。
考点:考查沉淀溶解平衡。

练习册系列答案
相关题目
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为:1×10-3mol·L-1,则该溶液中溶质的pC=3。下列表达正确的是
| A.某温度下任何电解质的水溶液中,pC(H+) +pC(OH-)=14 |
| B.0.01mol/L的CaCl2溶液中逐渐滴加纯碱溶液,滴加过程中pC(Ca2+)逐渐减小 |
| C.用0.01mol/L的盐酸滴定某浓度的NaOH溶液,滴定过程中pC(H+)逐渐增大 |
| D.某温度下,AB难溶性离子化合物的Ksp=1.0×10-10, 其饱和溶液中pC(A+) +pC((B-)=10 |
下列溶液中微粒的物质的量浓度关系正确的是
| A.25℃时,pH=7的NH4Cl与NH3?H2O混合溶液:c(H+)=c(OH-)=c(NH4+)=c(Cl-) |
| B.0.1mol/LNa2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C.25℃时,pH=2的CH3COOH与pH=12的NaOH等体积混合: c(CH3COO-)+c(H+)<c(Na+)+c(OH-) |
| D.0.1mol/LNa2CO3溶液:2c(CO32-)+2c(HCO-)+2c(H2CO3)=c(Na+) |
下列能正确表示水解的离子方程式是
A.CH3COOH + H2O  CH3COO- + H3O+ CH3COO- + H3O+ |
B.NH4+ + H2O  NH3·H2O + H+ NH3·H2O + H+ |
C.CO32- + 2H2O H2CO3 + 2OH- H2CO3 + 2OH- |
D.Br- + H2O  HBr + OH- HBr + OH- |
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
(2)CuSO4+Na2S: Cu2++S2-=CuS↓
下列几种物质的溶解度大小的比较中,正确的是
| A.CuS<Cu(OH)2<CuCO3 | B.CuCO3<Cu(OH)2<CuS |
| C.CuS<CuCO3<Cu(OH)2 | D.Cu(OH)2<CuCO3<CuS |
室温下,在pH为5的NH4Cl溶液、pH为9的NaHCO3溶液和pH为5的盐酸中,水的电离度分别为:α1、α2、α3,它们之间的大小关系是 ( )
| A.α1<α2<α3 | B.α1=α2>α3 | C.α1>α2>α3 | D.无法判断 |
下列各溶液中,微粒物质的量浓度关系正确的是( )
A.0.1 mol·L-1Na2CO3溶液中c(OH-)=c(HC )+c(H+)>c(C )+c(H+)>c(C ) ) |
B.0.1 mol·L-1(NH4)2SO4溶液中:c(S )>c(N )>c(N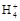 )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(OH-)>c(HC )>c(H+) )>c(H+) |
| D.0.1 mol·L-1Na2S溶液中:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) |
25℃时,某难溶性碱MOH在水中的沉淀溶解平衡曲线如图所示(单位:mol·L-1)。下列说法正确的是( )
| A.该碱在25℃时的Ksp为2×10-10 |
| B.a点的Ksp大于b点的Ksp |
| C.通过蒸发可使溶液由b点变为c点 |
| D.25℃时,要使c(M+)为0.1 mol·L-1的溶液形成沉淀,溶液的pH至少要升高到5 |

