题目内容
25 ℃时,在25 mL 0.1 mol·L-1的NaOH溶液中逐渐加入0.2 mol·L-1 CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论正确的是( )
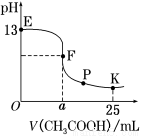
A.a=12.5,且混合溶液pH=7
B.对应曲线上E、F之间的任何一点,溶液中都有 c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.K点时,c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.P点时,c(CH3COO-)>c(Na+)>c(H+)=c(OH-)
研究CO、NOx、SO2等的处理方法对环境保护有重要意义。
(1)科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:
2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=-746.8kJ·mol-1
2CO2(g)+N2(g) △H=-746.8kJ·mol-1
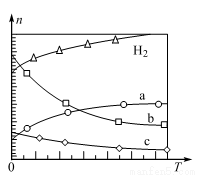
①为了研究外界条件对该反应的影响,进行下表三组实验,测得不同时刻NO的浓度(c)随时间变化的趋势如图1所示。1、2、3代表的实验编号依次是___________。
(已知在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。)
实验 编号 | 温度 (℃) | NO初始浓度 (mol·L-1) | CO初始浓度 (mol·L-1) | 催化剂比表面积(m2·g—1) | 催化剂用量(g) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 | 50 |
Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 | 50 |
Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 | 50 |
②图2表示NO的平衡转化率(α)随温度、压强变化的示意图。X表示的是__________,理由是________;Y表示的是________,且Y1________Y2(填“>”或“<”)。

(2)一定温度下,将NO2与SO2以体积比1:2置于密闭容器中发生反应NO2(g)+SO2(g) SO3(g)+NO(g),达到平衡时SO3的体积分数为25%。该反应的平衡常数K=___________。
SO3(g)+NO(g),达到平衡时SO3的体积分数为25%。该反应的平衡常数K=___________。
(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3 7N2+12H2O,电解质溶液为碱性。工作一段时间后,该电池负极区附近溶液pH________(填“变大”、“变小”或“不变”),正极电极反应式为____________。
7N2+12H2O,电解质溶液为碱性。工作一段时间后,该电池负极区附近溶液pH________(填“变大”、“变小”或“不变”),正极电极反应式为____________。



 NaOH溶液,则生成沉淀2的离子方程式为 。
NaOH溶液,则生成沉淀2的离子方程式为 。 1。
1。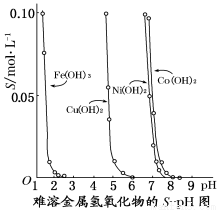

 CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下: