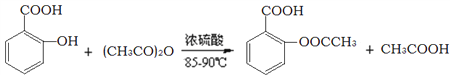
��Ŀ����
����Ŀ���л���A��һ�ֳ��õ��ڷ�ֹʹ����ҩ��1molAˮ��õ�1molB��1mol���ᣬA��Һ�������ԣ�����ʹFeCl3��Һ��ɫ��A����Է�������������200��B������̼Ԫ�غ���Ԫ�ص�����������Ϊ0.652��A��B������̼���⡢������Ԫ����ɵķ����廯����������ƶ��У���ȷ����
A. A��B����Է�������֮��Ϊ42
B. 1��B������Ӧ����2����ԭ��
C. A�ķ���ʽ��C7H6O3
D. B����NaOH��Һ��FeCl3��Һ�����ʷ�Ӧ����������ˮ��Ӧ
���𰸡�A
��������A��B����Է���������������200,��ȫȼ�ն�ֻ����CO2��H2O����B����̼����Ԫ���ܵ������ٷֺ���Ϊ0.652,����B+CH3COOH��A+H2O�ж�,����A����Է�������Ϊ200,��B�������Է�������Ϊ158,����34.8%,����ԭ�Ӹ���Ϊ:![]() ,��B�����к���3��Oԭ����A��B���Ƿ����廯������B��̼ԭ����Ϊ
,��B�����к���3��Oԭ����A��B���Ƿ����廯������B��̼ԭ����Ϊ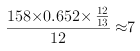 ,1molAˮ��õ�1molB��1mol����,A��Һ��������,����ʹFeCl3��Һ��ɫ,A�к��������Ȼ�������,��AΪ�����ᱽ��������,��ṹ����Ϊ
,1molAˮ��õ�1molB��1mol����,A��Һ��������,����ʹFeCl3��Һ��ɫ,A�к��������Ȼ�������,��AΪ�����ᱽ��������,��ṹ����Ϊ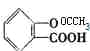 (���ڡ��䡢�����ֿ���),��A�ķ���ʽΪC9H8O4��BΪ�ǻ�������,�����ڡ��䡢������ͬ���칹��,���ֿ��ܵĽṹ��ʽΪ
(���ڡ��䡢�����ֿ���),��A�ķ���ʽΪC9H8O4��BΪ�ǻ�������,�����ڡ��䡢������ͬ���칹��,���ֿ��ܵĽṹ��ʽΪ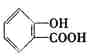 ��
��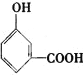 ��
��![]() ��A�ķ���ʽΪC9H8O4,B�ķ���ʽΪC7H6O3,�������C2H2O,���42, A��ȷ���л���B�ķ���ʽΪC7H6O3,1��B������Ӧ����3����ԭ�ӣ�B�������������Ϸ�������֪��,A�ķ���ʽΪC9H8O4, C�����л���B���ܵĽṹΪ
��A�ķ���ʽΪC9H8O4,B�ķ���ʽΪC7H6O3,�������C2H2O,���42, A��ȷ���л���B�ķ���ʽΪC7H6O3,1��B������Ӧ����3����ԭ�ӣ�B�������������Ϸ�������֪��,A�ķ���ʽΪC9H8O4, C�����л���B���ܵĽṹΪ �����з��ǻ����Ȼ�������B����NaOH��Һ�����кͷ�Ӧ����FeCl3��Һ������ɫ��Ӧ������ˮ�������ϵ�ȡ����Ӧ��D��������ȷѡ��A��
�����з��ǻ����Ȼ�������B����NaOH��Һ�����кͷ�Ӧ����FeCl3��Һ������ɫ��Ӧ������ˮ�������ϵ�ȡ����Ӧ��D��������ȷѡ��A��

����Ŀ��ij��ѧС���Ա�����Ϊԭ�ϣ���ȡ�������������֪�й����ʵķе����±���
���� | �״� | ������ | ��������� |
�е㣯�� | 64.7 | 249 | 199.6 |
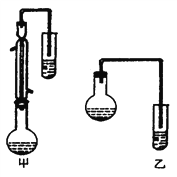
I���ϳɱ���������ֲ�Ʒ
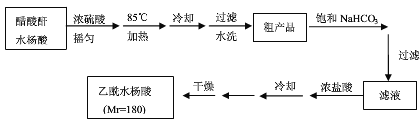
��Բ����ƿ�м���12.2g �������20 mL �״����ܶ�Լ0.79g �� mL��1) ����С�ļ���3 mL Ũ���ᣬ���Ⱥ�Ͷ�뼸�����Ƭ��С�ļ���ʹ��Ӧ��ȫ���ñ���������ֲ�Ʒ��
(1)Ũ�����������_________������Ӧ����ˮ��������ͬλ��18O��д���ܱ�ʾ��Ӧǰ��18Oλ�õĻ�ѧ����ʽ��__________________��
(2)������λͬѧ�ֱ����������ͼ����ʵ���Һϳɱ����������װ�ã��г������ͼ�������������ȥ���������л���ķе㣬��ò���_________װ�ã���ס����ҡ�����������___________________��
(3)��Ӧ��CH3 OH Ӧ������������__________________________________��
II���ֲ�Ʒ�ľ���
(4)����������ֲ�Ʒ���������������״������ᡢ�������ˮ�ȣ��ְ���������ͼ���о��ƣ���������ͼ��������������ǡ����������������______________��
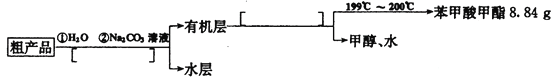
(5)ͨ�����㣬����������IJ���Ϊ_________________________��