题目内容
【题目】某研究性学习小组通过下列反应原理制备SO2并进行性质探究。反应原理为:Na2SO3(固)+H2SO4(浓)= Na2SO4 + SO2↑+ H2O

(1)根据上述原理制备并收集干燥SO2的实验装置连接顺序为________________。(填接头序号)
(2)D中盛装的试剂为_________________。
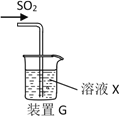
(3)甲同学用注射器吸取纯净的SO2并结合装置G进行SO2的性质实验,若X是Na2S溶液,其目的是检验SO2的_____________,可观察到的现象_________ 。
(4)实验1:乙同学将溶液X换为浓度均为0.1mol/L Fe(NO3)3和BaCl2的混合溶液(已经除去溶解氧),通入少量SO2后观察到烧杯产生白色沉淀,乙同学认为白色沉淀为BaSO4,为探究白色沉淀的成因,他继续进行如下实验验证:(已知:0.1mol/L Fe(NO3) 3的pH=2)
实验 | 操作 | 现象 | 结论和解释 |
2 | 将SO2通入0.1mol/L ____和BaCl2混合液 | 产生白色沉淀 | Fe3+能氧化H2SO3 |
3 | 将SO2通入_______ 和 BaCl2混合液 | 产生白色沉淀 | 酸性条件NO3-能将H2SO3氧化为SO42- |
【答案】 a f g d c e (写a f g d c f g e) NaOH溶液(或其它碱液) 氧化性 产生黄色沉淀(黄色浑浊或乳白色沉淀) FeCl3 0.01mol/L HNO3 (或pH=2 的HNO3 )
【解析】试题分析:本题考查SO2的实验室制备和SO2性质探究,实验方案的设计。
(1)根据反应原理,制备SO2属于“固体+液体→气体”;制得的SO2中混有H2O(g),用浓硫酸干燥SO2;SO2密度比空气大,用向上排空法收集;SO2污染大气,最后要进行尾气吸收,所以实验装置连接顺序为afgdce。
(2)D中盛装的试剂吸收SO2尾气,可用NaOH溶液。
(3)若X是Na2S溶液,由于酸性H2SO3![]() H2S,反应的过程为SO2与Na2S溶液作用生成H2S,H2S与SO2作用生成S和H2O,SO2被还原成S,所以实验目的是检验SO2的氧化性,可观察到的现象是:产生黄色沉淀。
H2S,反应的过程为SO2与Na2S溶液作用生成H2S,H2S与SO2作用生成S和H2O,SO2被还原成S,所以实验目的是检验SO2的氧化性,可观察到的现象是:产生黄色沉淀。
(4)白色沉淀为BaSO4,说明H2SO3被氧化成SO42-;根据Fe(NO3)3溶液的性质,可能是Fe3+将H2SO3氧化成SO42-,也可能是酸性条件下的NO3-将H2SO3氧化成SO42-;所以设计实验方案时用控制变量的对比实验。实验2要证明是Fe3+氧化H2SO3,所以选用与Fe(NO3)3含有相同Fe3+浓度的FeCl3溶液进行实验;实验3要证明是酸性条件下NO3-氧化H2SO3,所以选用与Fe(NO3)3溶液等pH的HNO3溶液进行实验。

 阅读快车系列答案
阅读快车系列答案【题目】PCl3有毒,在潮湿的空气中可发生水解反应产生大量的白雾。它在实验室和工业上都有重要的应用。在实验室中制取PCl3,在D中放入足量白磷,将Cl2迅速而且不间断地通入D中,氯气与白磷会发生反应,产生火焰。

三氯化磷和五氯化磷的物理常数如下:
熔点 | 沸点 | |
三氯化磷 | -112℃ | 76℃ |
五氯化磷 | 146℃ | 200℃分解 |
注:常温下五氯化磷不溶于三氯化磷
(1)写出A中发生反应的化学方程式:____________________________。
(2)反应开始前需要检查装置气密性,检查方法为____________________________。
(3)氯气和白磷反应放出大量的热,为使仪器D不致因局部过热而炸裂,实验开始前应在D的底部放少量____________________________。
(4)在烧杯E中加入冰盐水,其作用是____________________________。
(5)白磷与氯气反应产物中可能含有一定量的PCl5,从中分离出三氯化磷的方法是______________。经过一段时间反应发现B中竖直导管液面上开,可能的原因是____________________________。
(6)装置F的作用是____________________________。



