��Ŀ����
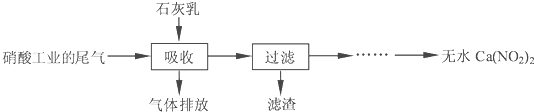
����ʯ��������Ṥҵ��β��(��NO��NO2)��Ӧ�����ܾ���β�������ܻ��Ӧ�ù㷺��Ca(NO2)2���䲿�ֹ����������£�

��ش��������⣺
��1��һ�������£�NO��NO2�������з�Ӧ��NO(g)��NO2(g)  N2O3(g)����ƽ�ⳣ������ʽΪK=
��
N2O3(g)����ƽ�ⳣ������ʽΪK=
��
��2�����������в�����Һ�����Ӵ�����(β�����������ײ����룬ʯ�������������������)����Ŀ���� ��������ѭ�����ã���������Ҫ�ɷ��� (�ѧʽ)��
��3���ù��������NO��NO2���ʵ���֮�Ƚӽ�1�U1����n(NO) ��n(NO2)��1�U1,��ᵼ�� ����n(NO) ��n(NO2)��1�U1,��ᵼ�� ��
��4����������Һ�豣�������ԣ���������Һ��Ca(NO2)2�ᷢ���ֽ⣬����֮һ��NO���䷴Ӧ�����ӷ���ʽ ��
��1��k=c(N2O3)/c(NO)��c(NO2) ��2��ʹβ����NO��NO2��������գ�Ca(OH)2��3����������NO�������ߣ���ƷCa(NO2)2��Ca(NO3)2�������ߣ�4��3NO2����2H��=NO3����2NO����H2O
��������
�����������1����ѧƽ�ⳣ������ָ��һ���¶��£����淴Ӧ�ﵽƽ��ʱ��������Ũ�ȵĻ�ѧ���������ݵij˻����Ը���Ӧ��Ũ�ȵĻ�ѧ���������ݵij˻����õı�ֵ��NO��g��+NO2��g��⇌N2O3��g������ƽ�ⳣ������ʽΪk=c(N2O3)/c(NO)��c(NO2)��2��ʹβ����NO��NO2��ʯ�����ֽӴ���NO��NO2��������գ�������Ҫ�ɷ���Ca(OH)2���ʴ�Ϊ��ʹβ����NO��NO2��������գ�Ca(OH)2 ����3����n��NO����n��NO2����1��1����һ�������������ŷ�������NO�������ߣ���n��NO����n��NO2����1��1�����������������������������ʯ���鷴Ӧ����Ca(NO3)2���ʴ�Ϊ���ŷ�������NO�������ߣ���ƷCa(NO2)2��Ca(NO3)2�������ߡ���4����Ӧ����NO2-��H+����������һ���������������ˮ����Ӧ�����ӷ���ʽΪ3NO2-+2H+=NO3-+2NO��+H2O���ʴ�Ϊ��3NO2-+2H+=NO3-+2NO��+H2O��
���㣺��������������ʼ���Ի�����Ӱ�죻��ѧƽ�ⳣ���ĺ���

 ��У����ϵ�д�
��У����ϵ�д�

 N2O3(g)����ƽ�ⳣ������ʽΪK��________��
N2O3(g)����ƽ�ⳣ������ʽΪK��________��
 N2O3(g)����ƽ�ⳣ������ʽΪK��________��
N2O3(g)����ƽ�ⳣ������ʽΪK��________��