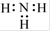题目内容
[2012·江苏卷](10分)利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下:

(1)一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)  N2O3(g),其平衡常数表达式为K=________。
N2O3(g),其平衡常数表达式为K=________。
(2)上述工艺中采用气—液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋),其目的是_____________ _________;滤渣可循环使用,滤渣的主要成分是__________(填化学式)。
(3)该工艺需控制NO和NO2物质的量之比接近1∶1。若n(NO)∶n(NO2)>1∶1,则会导致______________________ ___;若n(NO)∶n(NO2)<1∶1,则会导致_________________________________。
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式为______________________________。
(10分)(1)
(2)使尾气中的NO、NO2被充分吸收 Ca(OH)2
(3)排放气体中NO含量升高 产品Ca(NO2)2中Ca(NO3)2含量升高
(4)3NO2-+2H+===NO3-+2NO↑+H2O
【解析】本题主要考查工业制取Ca(NO2)2的流程分析。
(1)平衡常数表达式中用生成物浓度的幂指数的积除以反应物浓度的幂指数的积。
(2)逆流吸收尾气的目的是充分接触吸收。未反应的石灰乳变成滤渣,可以循环用于吸收尾气。
(3)当NO与NO2为1∶1,被Ca(OH)2吸收时的反应方程式为:NO+NO2+Ca(OH)2===Ca(NO2)2+H2O, NO2被Ca(OH)2吸收的反应方程式为4NO2+2Ca(OH)2===Ca(NO2)2+Ca(NO3)2+2H2O。注意NO不能单独被Ca(OH)2吸收,所以当NO的量比NO2多时,则会造成NO不能被吸收而在尾气中含量增多。当NO2比NO的量多时,过量的NO2将继续与Ca(OH)2反应生成Ca(NO3)2,使得产品不纯。
(4)Ca(NO2)2中N为+3价,生成NO中N为+2价,根据化合价升降总值相等,可推知产物有+5价的N生成,应为NO3- ,根据得失电子守恒而配平出NO3- 和NO前的化学计量数,再根据电荷守恒,确定出反应前有H+参加。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案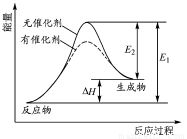
 Cl D.NH3的电子式:
Cl D.NH3的电子式: