题目内容
3.铈是一种重要的稀土金属元素,纳米CeO2可作抛光材料、催化剂载体(助剂)、汽车尾气吸收剂等,制备纳米CeO2的工艺流程如下(高铈中Ce显+4价):
回答下列问题:
(1)酸浸过程中,为了加快酸浸速率.可以采取的措施有将铈矿石粉碎或加热提高反应温度或适当增大硫酸的浓度等(写一条即可).
(2)H2O2的作用是将高铈硫酸盐还原.
(3)为了使硫酸铈溶液中的Ce3+沉淀完全,需加入氨水调节溶液pH至少为9.(已知:Ksp[Ce(OH)3]=1.0×10-20,当离子浓度≤1.0×10-5mol/L,认为离子沉淀完全)
(4)氧化过程中,氧化剂与还原剂的物质的量之比为1:4
(5)检验制备的CeO2是否为纳米级的方法是将产品分散至水中,用一束强光照射,若产生丁达尔效应,则制备的CeO2为纳米级.
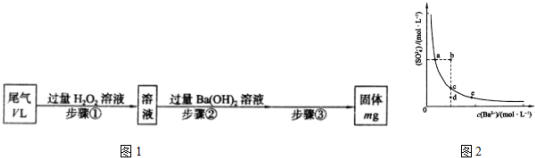
(6)高铈离子被还原的速率与温度的关系如图所示.图象中,温度高于T0时,高铈离子被还原的速率逐渐减小的原因是温度越高,双氧水的分解速率越快,使得溶液中双氧水的浓度减小,反应速率减慢.

(7)测定Ce(OH)4样品纯度:取mg样品用适量稀硫酸溶解后,加蒸馏水稀释至250mL.准确量取出20.00mL溶液于锥形瓶中,滴加几滴指示剂,用c mol/L的(NH4)2Fe(SO4)2标准溶液滴定至终点并记录消耗标准溶液的体积,将上述步骤重复3次,记录消耗标准溶液的平均体积为VmL.产品的纯度为$\frac{2.6cV}{m}$×100%.
分析 铈矿石加入硫酸酸浸得到高铈硫酸盐,加入过氧化物稀硫酸还原高铈硫酸盐得到硫酸铈溶液,加入氨水生成Ce(OH)2沉淀,通入氧气氧化得到Ce(OH)4,分解得到CeO2,
(1)酸浸过程中,为了加快酸浸速率,可以升温、增大浓度、增大接触面积等措施加快浸出速率;
(2)过氧化氢还原高铈硫酸盐得到硫酸铈溶液;
(3)Ksp[Ce(OH)3]=1.0×10-20,当离子浓度≤1.0×10-5mol/L,认为离子沉淀完全,依据溶度积常数计算得到氢氧根离子浓度;
(4)氧化过程中Ce(OH)2沉淀通入氧气氧化得到Ce(OH)4,氧气为氧化剂,Ce(OH)2沉为还原剂,依据电子转移守恒计算氧化剂和还原剂物质的量之比;
(5)制备的CeO2是否为纳米级,溶于水利用胶体的丁达尔效应检验;
(6)过氧化氢在外地升高时会分解,还原剂浓度减小,反应速率减小;
(7)Fe2+将四价铈还原成Ce3+,Fe2+被氧化为Fe3+,根据电子转移守恒n[Ce(OH)4]=n[(NH4)2Fe(SO4)2],进而计算产品纯度.
解答 解:(1)将铈矿石粉碎或加热提高反应温度或适当增大硫酸的浓度等都可以加快酸浸速率,
故答案为:将铈矿石粉碎或加热提高反应温度或适当增大硫酸的浓度等;
(2)过氧化氢还原高铈硫酸盐得到硫酸铈溶液,
故答案为:将高铈硫酸盐还原;
(3)Ksp[Ce(OH)3]=c(Ce3+)c3(OH-)=1.0×10-20,当离子浓度≤1.0×10-5mol/L,c3(OH-)=$\frac{1.0×1{0}^{-20}}{1.0×1{0}^{-5}}$=1.0×10-15,
c(OH-)=1.0×10-5mol/L,c(H+)=$\frac{1{0}^{-14}}{1{0}^{-5}}$=10-9mol/L,需加入氨水调节溶液pH至少为9,
故答案为:9;
(4)氧化过程中,4Ce(OH)3+2H2O+O2=4Ce(OH)4,氧化剂与还原剂的物质的量之比为1:4,
故答案为:1:4;
(5)检验制备的CeO2是否为纳米级的方法是利用胶体的特征性质,将产品分散至水中,用一束强光照射,若产生丁达尔效应,则制备的CeO2为纳米级,
故答案为:用一束强光照射,若产生丁达尔效应,则制备的CeO2为纳米级;
(6)高铈离子被还原的速率与温度的关系如图2所示.图象中,温度高于T0时,高铈离子被还原的速率逐渐减小的原因是:温度越高,双氧水的分解速率越快,使得溶液中双氧水的浓度减小,反应速率减慢,
故答案为:温度越高,双氧水的分解速率越快,使得溶液中双氧水的浓度减小,反应速率减慢;
(7)Fe2+将四价铈还原成Ce3+,Fe2+被氧化为Fe3+,根据电子转移守恒:n[Ce(OH)4]=n[(NH4)2Fe(SO4)2]=V×10-3L×cmol•L-1×$\frac{250ml}{20ml}$=0.0125cVmol,则m[Ce(OH)4]=208g/mol×0.0125cVmol=2.6cV g
故样品的纯度为$\frac{2.6cVg}{mg}$×100%=$\frac{2.6cV}{m}$×100%,
故答案为:$\frac{2.6cV}{m}$×100%.
点评 本题考查了物质组成和成分的探究、物质的分离提纯方法、滴定实验过程分析和计算等,为高考常见题型,侧重分析、推断及实验能力的综合考查,题目难度中等.

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案| A. | CO32-、NO3- | B. | Na+、Cl- | C. | Na+、NO3- | D. | Cl-、Na+、NO3- |
| A. | 液溴保存过程中,应在其液面上加少量水进行液封 | |
| B. | 少量的碱金属单质均应保存在煤油中 | |
| C. | FeCl3溶液存放时应加少量盐酸 | |
| D. | AgNO3溶液和KMnO4溶液均应存放在棕色试剂瓶中 |
| A. | 加热蒸干Na2CO3溶液,最后可以得到NaOH和Na2CO3的混合固体 | |
| B. | 除去MgCl2中的Fe3+,可以加入NaOH固体 | |
| C. | 明矾净水的反应:Al3++3H2O?Al(OH)3(胶体)+3H+ | |
| D. | 加热蒸干KCl溶液,最后得到KOH固体(不考虑CO2的反应) |