题目内容
已知H—H键键能(断裂时吸收或生成时释放的能量)为436 kJ·mol-1,N—H键键能为391 kJ·mol-1,根据热化学方程式:N2(g)+3H2(g)===2NH3(g) ΔH=-92.4 kJ·mol-1。则N≡N键的键能是
| A.431 kJ·mol-1 | B.945.6 kJ·mol-1 |
| C.649 kJ·mol-1 | D.896 kJ·mol-1 |
B
解析试题分析:设N≡N键的键能是x。由于反应热就是断键吸收的能量和形成化学键所放出的能量的差值,据此可知x+3×436 kJ/mol-2×3×391 kJ/mol=-92.4 kJ/mol,解得x=945.6 kJ/mol,答案选B。
考点:考查反应热的计算和应用
点评:该题是高考中的常见题型和考点,属于中等难度试题的考查。在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力。该题的关键是明确反应热与化学键键能的关系,然后根据方程式直接列式计算即可。

从能量的变化和反应的快慢等角度研究反应: 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
A.使用催化剂 B.适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。
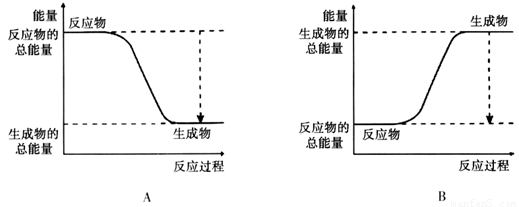
(3)从断键和成键的角度分析上述反应中能量的变化。
【资料】①键能:拆开1mol化学键需要吸收的能量,或是形成1mol化学键所放出的能量称为键能。
②化学键的键能:
|
化学键 |
H—H |
O=O |
H—O |
|
键能 |
436 |
496 |
463 |
请填写下表:
|
化学键 |
填“吸收热量” 或“放出热量” |
能量变化 |
|
|
拆开化学键 |
|
_______________ |
_______________ |
|
|
|||
|
形成化学键 |
|
_______________ |
_______________ |
|
总能量变化 |
_______________ |
_______________ |
(4)氢氧燃料电池的总反应方程式为 。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
(8分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,
(1)上图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式: ;
(2)若已知下列数据:
| 化学键 | H-H | N≡N |
| 键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N-H的键能 kJ·mol-1
(3)合成氨反应通常用铁触媒作催化剂。使用铁触媒后E1和E2的变化是:E1______,E2______(填“增大”、“减小、”“不变”)。
(4)用NH3催化还原NOX还可以消除氮氧化物的污染。例如
4NH3(g)+3O2(g) 2N2(g)+6H2O(g);△H1= akJ·mol-1
N2(g)+O2(g) 2NO(g);△H2= bkJ/mol
若1mol NH3还原NO至N2,则该反应过程中的反应热△H3= kJ/mol(用含a、b的式子表示)
【解析】(1)根据反应进程可判断反应物的能量高,生成物的能量低,所以热化学方程式为N2(g)+3H2(g)2NH3(g) △H=-92 kJ/mol。
(2)反应热就是断键吸收的能量和成键所放出的能量的差值,所以有943kJ/mol+3×435kJ/mol-2×3×x=-92 kJ/mol ,解得x=390 kJ/mol。
(3)催化剂能降低反应的活化能,但不能改变反应热,所以E1和E2均减小。
(4)考查盖斯定律的应用,将已知的2个热化学方程式叠加即得到
4NH3+6NO=6H2O+5N2 △H=(a-3b)kJ/mol。所以1mol NH3还原NO至N2,则该反应过程中的反应热![]() kJ/mol。
kJ/mol。
(8分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,

(1)上图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式: ;
(2)若已知下列数据:
|
化学键 |
H-H |
N≡N |
|
键能/kJ·mol-1 |
435 |
943 |
试根据表中及图中数据计算N-H的键能 kJ·mol-1
(3)合成氨反应通常用铁触媒作催化剂。使用铁触媒后E1和E2的变化是:E1______,E2______(填“增大”、“减小、”“不变”)。
(4)用NH3催化还原NOX还可以消除氮氧化物的污染。例如
4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
;△H1= akJ·mol-1
N2(g)+O2(g) 2NO(g);△H2= bkJ/mol
若1mol NH3还原NO至N2,则该反应过程中的反应热△H3= kJ/mol(用含a、b的式子表示)
【解析】(1)根据反应进程可判断反应物的能量高,生成物的能量低,所以热化学方程式为N2(g)+3H2(g) 2NH3(g) △H=-92 kJ/mol。
2NH3(g) △H=-92 kJ/mol。
(2)反应热就是断键吸收的能量和成键所放出的能量的差值,所以有943kJ/mol+3×435 kJ/mol-2×3×x=-92 kJ/mol ,解得x=390 kJ/mol。
(3)催化剂能降低反应的活化能,但不能改变反应热,所以E1和E2均减小。
(4)考查盖斯定律的应用,将已知的2个热化学方程式叠加即得到
4NH3+6NO=6H2O+5N2 △H=(a-3b)kJ/mol。所以1mol NH3还原NO至N2,则该反应过程中的反应热 kJ/mol。
kJ/mol。
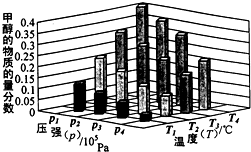 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚. [Cu(NH3)3]Ac•CO(aq)(△H<0)
[Cu(NH3)3]Ac•CO(aq)(△H<0)
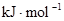

 中的化学键
中的化学键 中的化学键
中的化学键 键
键